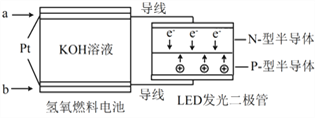
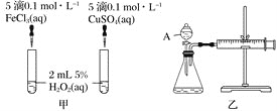
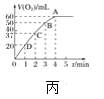
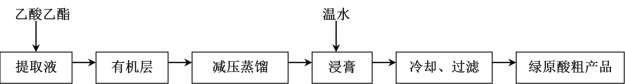
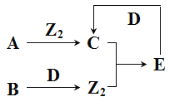
题目内容
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如图:
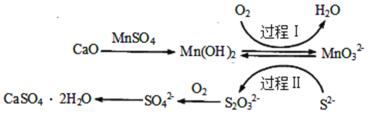
下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO![]() (S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
【答案】B
【解析】
A. 催化剂在反应中参加又生成,由图可知,过程Ⅰ、Ⅱ中,起催化剂作用的物质是Mn(OH) 2,故A正确;
B. 56g CaO(1mol)溶于水,与水反应产生1mol氢氧化钙,但氢氧化钙微溶于水,部分会形成沉淀,因此溶液中的钙离子数目小于6.02×1023个,故B错误;
C. 由电子守恒及原子守恒可知,存在2S2-~![]() ~4Mn(OH)2~8e -~2O2,且两个过程消耗氧气,将10L上清液中的S2-转化为
~4Mn(OH)2~8e -~2O2,且两个过程消耗氧气,将10L上清液中的S2-转化为![]() (S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为
(S2-浓度为320mg/L),理论上共需要标准状况下的O2的体积为![]() ,故C正确;
,故C正确;
D. 过程Ⅱ中S2-与![]() 发生氧化还原反应,离子反应为4MnO
发生氧化还原反应,离子反应为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-,故D正确;
+4Mn(OH)2↓+10OH-,故D正确;
故选:B。

练习册系列答案
相关题目