题目内容
【题目】硫酸亚铁铵(NH4)2Fe(SO4)26H2O又称莫尔盐,是浅绿色晶体。用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下:

已知:FeS2与H2SO4不反应。相应物质的溶解度曲线如下图。
(1)FeS2中S元素的化合价为______。
(2)硫铁矿焙烧的主反应是:4FeS2+11O2![]() 2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
2Fe2O3+8SO2,加快硫铁矿焙烧速率的措施有______(写两点即可)。
(3)加H2SO4酸浸,发生反应的离子方程式为______。
(4)“还原”时,Fe3+可通过反应Ⅰ、Ⅱ被FeS2还原。反应Ⅰ为:FeS2 +14Fe3+ +8H2O===15Fe2++ 2SO42—+16H+反应Ⅱ的离子方程式为:______。
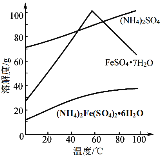
(5)得到莫尔盐晶体的操作是:蒸发浓缩、结晶、过滤、洗涤。结晶、过滤时选择的适宜温度为60℃,解释选择该温度的原因______。
(6)为证明所得莫尔盐晶体中含有Fe2+和NH4+,实验方法是取其少量溶液于一支试管中,______,证明含有Fe2+和NH4+。
【答案】-1 将硫铁矿粉碎、增大通入空气的量或提高焙烧温度 Fe2O3+ 6H+ = 2Fe3++3H2O FeS2 +2Fe3+ = 3Fe2++2S 60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高 加入适量浓氢氧化钠溶液,溶液中的白色沉淀迅速变灰绿,最终变为红褐色(1分);微热,用湿润的红色石蕊试纸接近试管口,观察到湿润的红色石蕊试纸变蓝(1分),证明含有Fe2+和NH4+
【解析】
硫铁矿焙烧时,FeS2与氧气高温下反应生成氧化铁和二氧化硫;加入稀硫酸,稀硫酸与氧化铁反应生成硫酸铁和水;硫酸铁和FeS2反应生成硫酸亚铁、硫(或硫酸);硫酸亚铁溶液与硫酸铵溶液按一定比例混合,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥得硫酸亚铁铵晶体。
(1)FeS2中Fe元素呈+2价,S元素呈—1价,故答案为:—1价;
(2)焙烧时,如果将硫铁矿粉碎,增大固体表面积,增加反应物的接触面积,可以加快硫铁矿焙烧速率;如果鼓入过量空气,增大氧气浓度,可以加快硫铁矿焙烧速率;如果升高温度,增大活化分子数,可以加快反应速率,故答案为:将硫铁矿粉碎、增大通入空气的量或提高焙烧温度;
(3)加H2SO4酸浸时,氧化铁与硫酸反应生成硫酸铁和水,反应的离子方程式为Fe2O3+ 6H+ = 2Fe3++3H2O。故答案为:Fe2O3+ 6H+ = 2Fe3++3H2O;
(4)由流程图可知,“还原”时,Fe3+和FeS2反应生成硫酸亚铁、硫(或硫酸),则反应Ⅱ为FeS2 +2Fe3+ = 3Fe2++2S,故答案为:FeS2 +2Fe3+ = 3Fe2++2S;
(5)由图可知,当温度为60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高,故答案为:60℃时,硫酸亚铁晶体的溶解度最大,硫酸铵较大,均比莫尔盐溶解度大,结晶时不宜析出,因此,选择60℃结晶、过滤,得到莫尔盐晶体的纯度更高;
(6)Fe2+和NH4+均能与碱反应,Fe2+与氢氧化钠溶液反应,溶液中立即生成白色沉淀,白色沉淀迅速变灰绿,最终变为红褐色;NH4+微热与氢氧化钠溶液反应,生成能使红色石蕊试纸变蓝的气体,故答案为:加入适量浓氢氧化钠溶液,溶液中的白色沉淀迅速变灰绿,最终变为红褐色;微热,用湿润的红色石蕊试纸接近试管口,观察到湿润的红色石蕊试纸变蓝,证明含有Fe2+和NH4+。

 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案






