题目内容
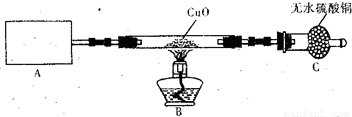
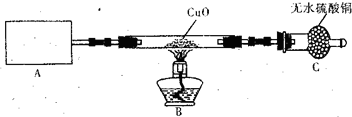
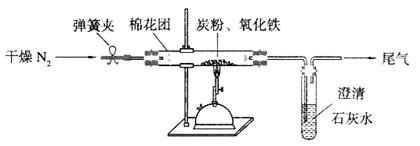
某化学研究小组同学认为NH3中N元素处于最低价,得出NH3应具有还原性的结论,并设计了如下实验装置进行研究(夹持装置未画出)
请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式______.
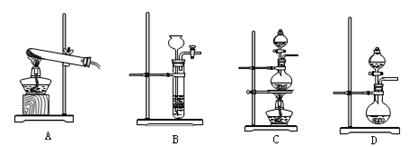
(2)该实验中的A部分的装置是下图中的______(填写装置的序号).

(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是______.
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施______.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.

请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式______.
(2)该实验中的A部分的装置是下图中的______(填写装置的序号).

(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是______.
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施______.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O.
(1)实验室中利用氯化铵和强碱氢氧化钙反应来获得氨气,即2NH4Cl+Ca(OH)4
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)4
CaCl2+2NH3↑+2H2O;
(2)根据实验目的,装置A为获得氨气的部分,可以用固体和液体加热的装置来获得氨气,故答案为:f;
(3)氧化铜能和还原性的氨气发生反应,生成金属铜和氮气、水,即3CuO+2NH3
3Cu+N2+3H2O,
故答案为:3CuO+2NH3
3Cu+N2+3H2O;
(4)无水硫酸铜变蓝可以检验水的生成,为了检验水是氨气和氧化铜反应的产物,一定要防止外界水的干扰,实验室制得的氨气中含有水,可以用碱石灰干燥,空气中的水也要防止进入C中,同时多余的氨气具有毒性,必须进行尾气处理,可以再C后面再接一个装有浓硫酸的洗气瓶,
故答案为:在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验;
(5)金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应,可以在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.
故答案为:在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.
| ||
| ||
(2)根据实验目的,装置A为获得氨气的部分,可以用固体和液体加热的装置来获得氨气,故答案为:f;
(3)氧化铜能和还原性的氨气发生反应,生成金属铜和氮气、水,即3CuO+2NH3
| ||
故答案为:3CuO+2NH3
| ||
(4)无水硫酸铜变蓝可以检验水的生成,为了检验水是氨气和氧化铜反应的产物,一定要防止外界水的干扰,实验室制得的氨气中含有水,可以用碱石灰干燥,空气中的水也要防止进入C中,同时多余的氨气具有毒性,必须进行尾气处理,可以再C后面再接一个装有浓硫酸的洗气瓶,
故答案为:在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验;
(5)金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应,可以在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.
故答案为:在试管中加入少量反应后的固体,然后滴加稀硫酸,震荡后观察,若溶液变蓝,则说明反应后的固体中含有氧化亚铜,如果无明显变化,则说明反应后的固体中不含有氧化亚铜.

练习册系列答案
相关题目
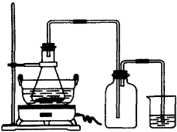 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀


 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。 CH3OH(g)
CH3OH(g)