题目内容
7.下列实验误差分析错误的是( )| A. | 用湿润的pH试纸测定稀酸的pH,测定值偏大 | |
| B. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 | |
| C. | 中和滴定前滴定管尖嘴处有气泡,终点读数时无气泡,所测溶液体积偏大 | |
| D. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 |
分析 A.湿润的pH试纸会导致测定的稀酸浓度降低,氢离子浓度降低;
B.应快速加入;
C.滴定后气泡消失,所测溶液体积偏大;
D.定容时俯视刻度线,导致所配溶液的体积偏小.
解答 解:A.湿润的pH试纸会导致测定的稀酸浓度降低,氢离子浓度降低,测定溶液pH偏大,故A正确;
B.将碱缓慢倒入酸中,热量散失,所测温度值偏小,故B正确;
C.滴定前有气泡,滴定后气泡消失,所测溶液体积偏大,故C正确;
D.定容时俯视刻度线,导致所配溶液的体积偏小,所配溶液的浓度偏大,故D错误.
故选D.
点评 本题考查化学实验方案的评价,涉及化学实验的基本操作、物质的性质等,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,注意把握物质的性质以及实验的严密性和可行性的评价,难度中等.

练习册系列答案
相关题目
18.下列事实不能用勒夏特列原理来解释的是( )
| A. | NO2、N2O4混合气体加压,颜色先变深后变浅,比原来深 | |
| B. | H2(g)+I2(g)?2HI(g),加压混合气体颜色加深 | |
| C. | 饱和氯水光照后颜色变浅 | |
| D. | 碳酸钠、酚酞的混合溶液加热颜色变深 |
15.下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 30mL 0.2mol/L KCl溶液 | B. | 20mL 0.1mol/L CaCl2溶液 | ||
| C. | 100mL 0.25mol/L NaCl溶液 | D. | 10mL 0.1mol/L AlCl3溶液 |
2.下列关于溶液的酸碱性说法正确的是( )
| A. | pH=7的溶液一定是中性 | |
| B. | 若某盐溶液呈酸性或碱性,一定是由于该盐发生了水解反应 | |
| C. | c(H+)<c(OH-)的溶液一定呈碱性 | |
| D. | 在100℃时,纯水的pH<7,因此显酸性 |
12.下列气体中.可以用来冷却镁蒸气的是( )
| A. | 空气 | B. | 二氧化碳 | C. | 氧气 | D. | 氩气 |
16.将0.2mol•L-1的H2S溶液与0.2mol•L-1的NaOH溶液等体积混合后,所的溶液中各离子浓度大小关系正确的是( )
| A. | c(Na+)>c(OH-)>c(HS-)>c(S2-)>c(H+) | B. | c(Na+)>c(HS-)>c(H+)>c(S2-)>c(OH-) | ||
| C. | c(Na+)>c(HS-)>c(OH-)>c(H+)>c(S2-) | D. | c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+) |

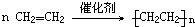 ;
;