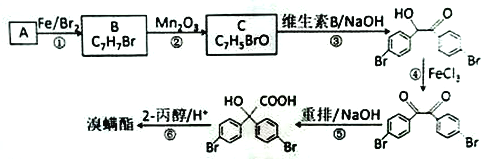
ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩ≤ίΥαΨßΧεΒΡΉι≥…Ω…±μ ΨΈΣH2C2O4ΓΛxH2OΘ§Ρ≥―–ΨΩ–‘―ßœΑ–ΓΉι”Οœ¬ΆΦΉΑ÷ΟΫχ––ΓΑ≤ίΥαΨßΧε ή»»Ζ÷ΫβΒΡ≤ΩΖ÷≤ζΈοΒΡ―ι÷ΛΓ±ΒΡ Β―ιΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΓΘ

ΓΨΉ Νœ≤ι‘ΡΓΩ
ΔΌ≤ίΥαΨßΧε‘Ύ101 Γφ ±ΩΣ Φ»έΜ·Θ§150 Γφ ±ΩΣ Φ…ΐΜΣΘ§175 Γφ ±ΩΣ ΦΖ÷ΫβΘΜ
ΔΎ≤ίΥαΗΤΚΆ≤ίΥα«βΗΤΨυΈΣΑΉ…Ϊ≤Μ»ήΈοΓΘ
Θ®1Θ©Α¥’’»γΆΦΥυ ΨΒΡΉΑ÷ΟΘ§Ά®Ιΐ Β―ιΦλ―ι≤ίΥαΨßΧεΒΡ≤ΩΖ÷Ζ÷Ϋβ≤ζΈοΘ§ΉΑ÷ΟB÷–Ω…Ιέ≤λΒΫ”–Τχ≈ίΟΑ≥ω«“≥Έ«ε ·Μ“Υ°±δΜκΉ«Θ§”…¥ΥΦΉΆ§―ß≈–Εœ≤ίΥαΨßΧεΖ÷ΫβΒΡ≤ζΈο÷–”–CO2ΓΘΒΪΝΔΦ¥‘βΒΫ““Ά§―ßΖ¥Ε‘Θ§ΤδΖ¥Ε‘ΒΡάμ”…Ω…Ρή «______________________________________ΓΘ
Θ®2Θ©±ϊΆ§―ß»œΈΣ≤ίΥαΨßΧεΖ÷ΫβΒΡ≤ζΈο÷–Κ§”–COΘ§ΈΣΫχ––―ι÷ΛΘ§X”Π―Γ”Ο________(ΧνΜ·―ß Ϋ)≈®»ή“ΚΘ§ΉΑ÷ΟDΒΡΉς”Ο «____________________ΓΘ
Θ®3Θ© Β―ιΙΐ≥Χ÷–…φΦΑ»γœ¬≤ΌΉςΘΚΔΌΒψ»ΦΉΑ÷ΟA¥ΠΒΡΨΤΨΪΒΤΘΜΔΎœ®ΟπΉΑ÷ΟA¥ΠΒΡΨΤΨΪΒΤΘΜΔέΒψ»ΦΉΑ÷ΟE¥ΠΒΡΨΤΨΪΒΤΘΜΔήœ®ΟπΉΑ÷ΟE¥ΠΒΡΨΤΨΪΒΤΓΘ’β4≤Ϋ≤ΌΉς”…œ»ΒΫΚσΒΡΥ≥–ρΈΣ____________(Χν–ρΚ≈)ΓΘΒψ»ΦE¥ΠΨΤΨΪΒΤ«Α±Ί–κ“ΣΫχ––ΒΡ≤ΌΉς «______________ΓΘ
Θ®4Θ© Β―ιΙΐ≥Χ÷–ΖΔœ÷ΉΑ÷ΟE÷–ΚΎ…ΪΖέΡ©±δΚλ…ΪΘ§ΉΑ÷ΟF÷–”–ΚΎ…ΪΙΧΧε…ζ≥…Θ§Ψ≠Φλ≤βΉΑ÷ΟF÷–ΒΡΙΧΧεΈΣΫπ τΒΞ÷ Θ§‘ρΉΑ÷ΟF÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________________________________________________________________ΓΘ
Θ®5Θ©ΕΓΆ§―ß”ΟΒΈΕ®Ζ®≤βΕ®≤ίΥαΨßΧε÷–ΫαΨßΥ°ΒΡΚ§ΝΩΘ§Ϋχ––ΝΥœ¬Ν–≤ΌΉςΘΚ
≤Ϋ÷η“ΜΘΚ”ΟΖ÷ΈωΧλΤΫ≥Τ»Γ3.15 g¥ΩΨΜΒΡΗΟ≤ίΥαΨßΧεΘ§≈δ÷Τ≥…250 mL»ή“ΚΓΘ
≤Ϋ÷ηΕΰΘΚ”Ο“Τ“ΚΙή“Τ»Γ25.00 mL¥ΐ≤β≤ίΥα»ή“Κ”ΎΉΕ–ΈΤΩ÷–Θ§≤ΔΦ”»κ ΝΩΝρΥαΥαΜ·ΓΘ
≤Ϋ÷η»ΐΘΚ»Γ0.100 molΓΛLΘ≠1±ξΉΦΥα–‘KMnO4»ή“ΚΘ§Ϋχ––ΒΈΕ®Θ§»ΐ¥ΈΫαΙϊ»γœ¬±μΥυ ΨΘΚ
ΒΎ“Μ¥Έ | ΒΎΕΰ¥Έ | ΒΎ»ΐ¥Έ | |
¥ΐ≤β»ή“ΚΧεΜΐ(mL) | 25.00 | 25.00 | 25.00 |
±ξΉΦ»ή“ΚΧεΜΐ(mL) | 9.99 | 10.01 | 10.00 |
“―÷ΣΒΈΕ®Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚMnO![]() ΘΪH2C2O4ΘΪHΘΪ®DΓζMn2ΘΪΘΪCO2ΓϋΘΪH2O(Έ¥≈δΤΫ)ΓΘ
ΘΪH2C2O4ΘΪHΘΪ®DΓζMn2ΘΪΘΪCO2ΓϋΘΪH2O(Έ¥≈δΤΫ)ΓΘ
ΔΌ≈δ÷Τ≤ίΥα»ή“ΚΒΡ≤ΌΉς≤Ϋ÷η“ά¥Έ «ΘΚΫΪΨßΧε÷Ο”Ύ…’±≠÷–Θ§Φ”Υ°»ήΫβΘ§ΫΪ»ή“ΚΉΣ“Τ»κ________Θ§œ¥Β”Θ§Ε®»ίΘ§“Γ‘»ΓΘ
ΔΎΆ®ΙΐΦΤΥψ»ΖΕ®xΘΫ________ΓΘ
ΓΨ¥πΑΗΓΩ Μ”ΖΔ≥ωΒΡ≤ίΥα”κ≥Έ«ε ·Μ“Υ°Ζ¥”Π“≤≤ζ…ζœύΆ§ΒΡœ÷œσ(Μρ“ρΈΣ≤ίΥαΗΤΓΔ≤ίΥα«βΗΤΕΦΈΣΑΉ…Ϊ≥ΝΒμ) NaOH Η…‘οCO(Μρ≥ΐ»ΞCO÷–ΒΡΥ°’τΤχ) ΔΌΔέΔήΔΎ Φλ―ιCOΒΡ¥ΩΕ» PdCl2ΘΪH2OΘΪCO===PdΓΐΘΪCO2ΘΪ2HCl 250 mL»ίΝΩΤΩ 2
ΓΨΫβΈωΓΩΘ®1Θ©≤ίΥαΨßΧε‘Ύ101Γφ ±ΩΣ Φ»έΜ·Θ§150Γφ ±ΩΣ Φ…ΐΜΣΘ§“ρ¥ΥΦ”»»Ζ÷Ϋβ ±Θ§Μ”ΖΔ≥ωΒΡ≤ίΥα”κ≥Έ«ε ·Μ“Υ°Ζ¥”Π“≤≤ζ…ζΑΉ…Ϊ≥ΝΒμΘΜ’ΐ»Ζ¥πΑΗΘΚΜ”ΖΔ≥ωΒΡ≤ίΥα”κ≥Έ«ε ·Μ“Υ°Ζ¥”Π“≤≤ζ…ζœύΆ§ΒΡœ÷œσΘ®ΜρΘΚ“ρΈΣ≤ίΥαΗΤΓΔ≤ίΥα«βΗΤΕΦΈΣΑΉ…Ϊ≥ΝΒμΘ©ΓΘ
Θ®2Θ©≤ίΥα ή»»Ζ÷ΫβΘ§Ω…Ρή≤ζ…ζCOΚΆCO2Θ§“ρ¥ΥΘ§‘Ύ―ι÷ΛCOΤχΧε÷°«ΑΘ§œ»≥ΐ»ΞCO2Θ§X”Π―Γ”ΟNaOH»ή“ΚΘ§ Η…‘οΒΡCOΡήΙΜΜΙ‘≠―θΜ·Ά≠Θ§“ρ¥ΥΘ§±Ί–κ”Ο≈®ΝρΥαΗ…‘οCOΤχΧεΘ§’ΐ»Ζ¥πΑΗΘΚNaOHΘΜΗ…‘οCOΘ®ΜρΘΚ≥ΐ»ΞCO÷–ΒΡΥ°’τΤχΘ©ΓΘ
Θ®3Θ©œ»Βψ»ΦA¥ΠΒΡΨΤΨΪΒΤΘ§≤ζ…ζΤχΧεΘ§≈≈ΨΜΉΑ÷ΟΡΎΩ’ΤχΘ§»ΜΚσΦ”»»EΉΑ÷ΟΖ¥”ΠΖΔ…ζΘ§Ζ¥”ΠΫα χΚσΘ§œ»œ®ΟπE¥ΠΨΤΨΪΒΤΘ§ά以÷Ν “Έ¬ΚσΘ§‘Ύœ®ΟπA¥ΠΒΡΨΤΨΪΒΤΘ§“‘Ζά≤ζ…ζΒΙΈϋΘΜΥυ“‘’β4≤Ϋ≤ΌΉς”…œ»ΒΫΚσΒΡΥ≥–ρΈΣΔΌΔέΔήΔΎΘΜΒψ»ΦE¥ΠΨΤΨΪΒΤ«Α±Ί–κ“ΣΫχ––ΒΡ≤ΌΉς «Φλ―ιCOΒΡ¥ΩΕ»ΘΜ’ΐ»Ζ¥πΑΗΘΚΔΌΔέΔήΔΎΘΜΦλ―ιCOΒΡ¥ΩΕ»Θ§Θ®Χεœ÷ΓΑ―ι¥ΩΓ±Θ©ΓΘ
Θ®4Θ©PdCl2”κΕύ”ύΒΡCOΖ¥”Π…ζ≥…Ϋπ τPdΘ§CO±Μ―θΜ·ΈΣCO2ΘΜΜ·―ßΖΫ≥Χ ΫΈΣPdCl2ΘΪH2OΘΪCO=== PdΓΐΘΪCO2ΘΪ2HClΘΜ’ΐ»Ζ¥πΑΗΘΚPdCl2ΘΪH2OΘΪCO=== PdΓΐΘΪCO2ΘΪ2HClΘΜ
Θ®5Θ©œϊΚΡKMnO4»ή“ΚΒΡΧεΜΐΈΣ9.99+10.01+10.00=10.00mLΘ§œϊΚΡKMnO4ΒΡΝΩΈΣ0.10ΓΝ10ΓΝ10-3=10-3 molΘ§25 mL≤ίΥα»ή“ΚœϊΚΡKMnO410-3 molΘ§250 mL≤ίΥα»ή“ΚœϊΚΡKMnO410-2 molΘΜΖ¥”Π»γœ¬ΘΚ2MnO4ΓΣ+5H2C2O4+6H+=2Mn2++10CO2Γϋ+8H2OΘ§ΗυΨίΖ¥”ΠΙΊœΒ2MnO4ΓΣ--5H2C2O4Θ§œϊΚΡH2C2O4ΒΡΝΩΈΣ2.5ΓΝ10-2 molΘ§3.15g¥ΩΨΜH2C2O4ΓΛxH2OΒΡΝΩΈΣ2.5ΓΝ10-2 molΘ§3.15/(90+18x)= 2.5ΓΝ10-2, x=2ΘΜ’ΐ»Ζ¥πΑΗΘΚ2ΓΘ

 ΗΏ–ß÷«ΡήΩΈ ±Ής“ΒœΒΝ–¥πΑΗ
ΗΏ–ß÷«ΡήΩΈ ±Ής“ΒœΒΝ–¥πΑΗ ΫίΨΕ―ΒΝΖΦλ≤βΨμœΒΝ–¥πΑΗ
ΫίΨΕ―ΒΝΖΦλ≤βΨμœΒΝ–¥πΑΗ –ΓΖρΉ”»ΪΡήΦλ≤βœΒΝ–¥πΑΗ
–ΓΖρΉ”»ΪΡήΦλ≤βœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΓΑ¬ΧΥ°«ύ…ΫΨΆ «Ϋπ…Ϋ“χ…ΫΓ±Θ§―–ΨΩNO2ΓΔNOΓΔCOΓΔS02Β»¥σΤχΈέ»ΨΈοΚΆΥ°Έέ»ΨΈοΒΡ¥ΠάμΕ‘Ϋ®…ηΟάάω÷–ΙζΨΏ”–÷Ί“Σ“β“εΓΘ
(1)“―÷ΣΘΚ ΔΌNO2+CO![]() CO2+NOΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣK1(œ¬Ά§)Θ§ΟΩ1molœ¬Ν–Έο÷ Ζ÷ΫβΈΣΤχΧ§ΜυΧ§‘≠Ή”Έϋ ’ΒΡΡήΝΩΖ÷±πΈΣ
CO2+NOΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐΈΣK1(œ¬Ά§)Θ§ΟΩ1molœ¬Ν–Έο÷ Ζ÷ΫβΈΣΤχΧ§ΜυΧ§‘≠Ή”Έϋ ’ΒΡΡήΝΩΖ÷±πΈΣ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
ΔΎN2(g)+O2(g) ![]() 2NO(g) ΓςH=+179.5kJ/mol K2
2NO(g) ΓςH=+179.5kJ/mol K2
Δέ2NO(g)+O2(g)![]() 2NO2(g) ΓςH=-112.3kJ/mol K3
2NO2(g) ΓςH=-112.3kJ/mol K3
–¥≥ωNO”κCOΖ¥”Π…ζ≥…ΈόΈέ»ΨΤχΧεΒΡ»»Μ·―ßΖΫ≥Χ Ϋ____________________________________Θ§ΗΟ»»Μ·―ßΖΫ≥Χ ΫΒΡΤΫΚβ≥Θ ΐK=_________(”ΟK1ΓΔK2ΓΔK3±μ Ψ)ΓΘ
(2)‘ΎΧεΜΐΩ…±δΒΡΚψ―Ι(pΉή)Οή±’»ίΤς÷–≥δ»κ1molCO2 ”κΉψΝΩΒΡΧΦΘ§»ΟΤδΖΔ…ζΖ¥”ΠΘΚ C(s)+ CO2(g)![]() 2CO(g) ΓςH>0ΓΘΤΫΚβ ±Θ§ΧεœΒ÷–ΤχΧεΧεΜΐΖ÷ ΐ”κΈ¬Ε»ΒΡΙΊœΒ»γœ¬ΆΦΥυ ΨΓΘ
2CO(g) ΓςH>0ΓΘΤΫΚβ ±Θ§ΧεœΒ÷–ΤχΧεΧεΜΐΖ÷ ΐ”κΈ¬Ε»ΒΡΙΊœΒ»γœ¬ΆΦΥυ ΨΓΘ
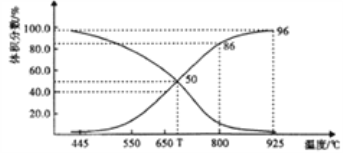
ΔΌTΓφ ±Θ§‘Ύ»ίΤς÷–»τ≥δ»κœΓ”–ΤχΧεΘ§v(’ΐ)___v(Ρφ)(ΧνΓΑ>Γ±ΓΑ<Γ±ΜρΓΑ=")Θ§ΤΫΚβ______“ΤΕ·(ΧνΓΑ’ΐœρΓ±ΓΑΡφœρΓ±ΜρΓΑ≤ΜΓ±ΓΘœ¬Ά§)ΘΜ»τ≥δ»κΒ»ΧεΜΐΒΡCO2 ΚΆCOΘ§ΤΫΚβ________“ΤΕ·ΓΘ
ΔΎCOΧεΜΐΖ÷ ΐΈΣ40% ±Θ§CO2 ΒΡΉΣΜ·¬ ΈΣ_______ΓΘ
Δέ“―÷ΣΘΚΤχΧεΖ÷―Ι(pΖ÷)=ΤχΧεΉή―ΙΓΝΧεΜΐΖ÷ ΐΓΘ”ΟΤΫΚβΖ÷―Ι¥ζΧφΤΫΚβ≈®Ε»±μ ΨΤΫΚβKp≥Θ ΐΒΡ±μ¥ο ΫΈΣ__________ΘΜ925Γφ ±Θ§Kp=______(”ΟΚ§pΉήΒΡ¥ζ ΐ Ϋ±μ Ψ)ΓΘ
(3)÷±Ϋ”≈≈Ζ≈Κ§SO2 ΒΡ―ΧΤχΜα–Έ≥…Υα”ξΘ§ΈΘΚΠΜΖΨ≥ΓΘΩ…”ΟNaOHΈϋ ’Θ§ΥυΒΟΚ§ΝρΗςΈΔΝΘ(H2SO3ΓΔHSO3-ΚΆSO32-)¥φ‘Ύ”ΎΖ¥”ΠΚσΒΡ»ή“Κ÷–Θ§ΥϋΟ«ΒΡΈο÷ ΒΡΝΩΖ÷ ΐX(i)”κ»ή“ΚpHΒΡΙΊœΒ»γΆΦΥυ ΨΓΘ

ΔΌ»τ «0.1mol/LNaOH Ζ¥”ΠΚσΒΡ»ή“ΚΘ§≤βΒΟ»ή“ΚΒΡpH=8 ±Θ§»ή“Κ÷–ΗςάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρ «______________ΓΘ
ΔΎœρpH=5ΒΡNaHSO3»ή“Κ÷–ΒΈΦ”“ΜΕ®≈®Ε»ΒΡCaCl2 »ή“ΚΘ§»ή“Κ÷–≥ωœ÷ΜκΉ«Θ§pHΫΒΈΣ2Θ§”ΟΜ·―ßΤΫΚβ“ΤΕ·‘≠άμΫβ Ά»ή“ΚpHΫΒΒΆΒΡ‘≠“ρ_______________________________________________ΓΘ
ΓΨΧβΡΩΓΩNH3ΉςΈΣ“Μ÷÷÷Ί“ΣΜ·ΙΛ‘≠ΝœΘ§±Μ¥σΝΩ”Π”Ο”ΎΙΛ“Β…ζ≤ζΘ§”κΤδ”–ΙΊ–‘÷ Ζ¥”ΠΒΡ¥ΏΜ·ΦΝ―–ΨΩ‘χ±ΜΝ–»κΙζΦ“863ΦΤΜ°ΓΘ¥ΏΜ·ΦΝ≥ΘΨΏ”–Ϋœ«ΩΒΡ―Γ‘ώ–‘Θ§Φ¥Ή®“Μ–‘ΓΘ“―÷ΣΘΚ
Ζ¥”ΠIΘΚ4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) ΓςH=®D905.0 kJΓΛmolΓΞ1
4NO(g) +6H2O(g) ΓςH=®D905.0 kJΓΛmolΓΞ1
Ζ¥”Π IIΘΚ4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) ΓςH
2N2(g) +6H2O(g) ΓςH
Θ®1Θ©
Μ·―ßΦϋ | HΓΣO | O=O | NΓ‘N | NΓΣH |
ΦϋΡήkJΓΛmolΓΞ1 | 463 | 496 | 942 | 391 |
ΓςH=__________________ ΓΘ
Θ®2Θ©‘ΎΚψΈ¬Κψ»ίΉΑ÷Ο÷–≥δ»κ“ΜΕ®ΝΩΒΡNH3ΚΆO2Θ§‘ΎΡ≥¥ΏΜ·ΦΝΒΡΉς”Οœ¬Ϋχ––Ζ¥”ΠIΘ§‘ρœ¬Ν–”–ΙΊ–π ω÷–’ΐ»ΖΒΡ «__________________ΓΘ
AΘ° Ι”Ο¥ΏΜ·ΦΝ ±Θ§Ω…ΫΒΒΆΗΟΖ¥”ΠΒΡΜνΜ·ΡήΘ§Φ”ΩλΤδΖ¥”ΠΥΌ¬
BΘ°»τ≤βΒΟ»ίΤςΡΎ4v’ΐ(NH3)=6vΡφ(H2O) ±Θ§ΥΒΟςΖ¥”Π“―¥οΤΫΚβ
CΘ°Β±»ίΤςΡΎ![]() =1 ±Θ§ΥΒΟςΖ¥”Π“―¥οΤΫΚβ
=1 ±Θ§ΥΒΟςΖ¥”Π“―¥οΤΫΚβ
Θ®3Θ©Α±¥ΏΜ·―θΜ· ±ΜαΖΔ…ζ…œ ωΝΫΗωΨΚ’υΖ¥”ΠIΓΔIIΓΘΈΣΖ÷ΈωΡ≥¥ΏΜ·ΦΝΕ‘ΗΟΖ¥”ΠΒΡ―Γ‘ώ–‘Θ§‘Ύ1LΟή±’»ίΤς÷–≥δ»κ1 mol NH3ΚΆ2mol O2Θ§≤βΒΟ”–ΙΊΈο÷ ΒΡΝΩΙΊœΒ»γœ¬ΆΦΘΚ
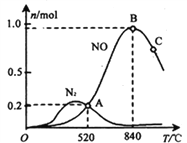
ΔΌΗΟ¥ΏΜ·ΦΝ‘ΎΗΏΈ¬ ±―Γ‘ώΖ¥”Π____________ (ΧνΓΑ I Γ±ΜρΓΑ IIΓ±Θ©ΓΘ
ΔΎ 520Γφ ±Θ§4NH3(g)+5O2![]() 4NO(g) +6H2O(g)ΒΡΤΫΚβ≥Θ ΐK=____________________________ (≤Μ“Σ«σΒΟ≥ωΦΤΥψΫαΙϊΘ§÷Μ–ηΝ–≥ω ΐΉ÷ΦΤΥψ ΫΘ©ΓΘ
4NO(g) +6H2O(g)ΒΡΤΫΚβ≥Θ ΐK=____________________________ (≤Μ“Σ«σΒΟ≥ωΦΤΥψΫαΙϊΘ§÷Μ–ηΝ–≥ω ΐΉ÷ΦΤΥψ ΫΘ©ΓΘ
Δέ”–άϊ”ΎΧαΗΏNH3ΉΣΜ·ΈΣN2ΤΫΚβΉΣΜ·¬ ΒΡ¥κ ©”–_______________
AΘ° Ι”Ο¥ΏΜ·ΦΝPt/Ru
BΘ° Ι”Ο¥ΏΜ·ΦΝCu/TiO2
CΘ°‘ω¥σNH3ΚΆO2ΒΡ≥θ ΦΆΕΝœ±»
DΘ°ΆΕΝœ±»≤Μ±δΘ§‘ωΦ”Ζ¥”ΠΈοΒΡ≈®Ε»
EΘ°ΫΒΒΆΖ¥”ΠΈ¬Ε»
Θ®4Θ©≤…”ΟΑ±Υ°Έϋ ’―ΧΤχ÷–ΒΡSO2Θ§
ΔΌ»τΑ±Υ°”κSO2«ΓΚΟΆξ»ΪΖ¥”Π…ζ≥…’ΐ―ΈΘ§‘ρ¥Υ ±»ή“Κ≥ _____–‘Θ®ΧνΓΑΥαΓ±ΜρΓΑΦνΓ±Θ©≥ΘΈ¬œ¬»θΒγΫβ÷ ΒΡΒγάκΤΫΚβ≥Θ ΐ»γœ¬ΘΚΑ±Υ°ΘΚKb=1.8ΓΝ10ΓΞ5molΓΛLΓΞ1ΘΜH2SO3 ΘΚKa1=1.3ΓΝ10ΓΞ2molΓΛLΓΞ1Θ§Ka2=6.3ΓΝ10ΓΞ8molΓΛLΓΞ1
ΔΎ…œ ω»ή“Κ÷–Ά®»κ______ΤχΧεΩ… Ι»ή“Κ≥ ÷––‘Θ§Θ®ΧνΓΑSO2Γ±ΜρNH3Γ±Θ©¥Υ ±»ή“ΚάκΉ”≈®Ε»”…¥σΒΫ–ΓΒΡΥ≥–ρ_________________________________ΓΘ