题目内容
【题目】将Cu放入0.1 molL﹣1FeCl3溶液中,反应一段时间后取出Cu片,溶液中Fe3+与Fe2+的物质的量浓度之比为4:3,则反应后溶液中Cu2+与Fe3+的物质的量之比为
A.3:2 B.3:8 C.4:3 D.3:4
【答案】B
【解析】
试题分析:将Cu片放入FeCl3溶液中.发生反应:Cu+2Fe3+=Cu2++2Fe2+,假设溶液中n(Fe2+)=3mol,则溶液中n(Fe3+)=4mol,由离子方程式可知,n(Cu2+)=1/2n(Fe2+)=1/2×3mol=1.5mol,所以n(Cu2+):n(Fe3+)=1.5mol:4mol=3:8,答案选B。

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
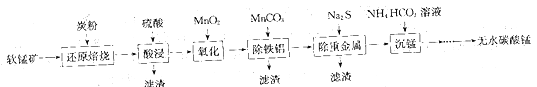
【题目】工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂的废气SO2,并制备
MnSO4·H2O晶体,其工艺流程如下:

已知:①浸出液的pH<2,其中的金属阳离子主要是Mn2+,还有少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
请回答下列问题:
(1)加入MnO2氧化时溶液中反应的离子方程式为_______________________________。
(2) 若流程中取消“加入MnO2”,对上述流程的影响是____________________________。
(3)试剂X能否选用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2],判断并说明理由: ________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是___________________。
(5)从滤液中提取MnSO4·H2O晶体的操作是___________________。