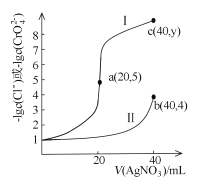
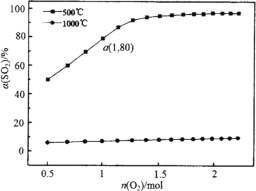
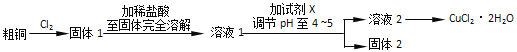题目内容
【题目】化合物 A 经李比希法和质谱法分析得知其相对分子质量为 136,分子式为 C8H8O2,A 的核磁共振氢谱如图:

峰面积之比为 1:2:2:3,A 分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱如图:

则 A 的结构简式为________
【答案】![]()
【解析】
有机物A的分子式为分子式C8H8O2,不饱和度为![]() =5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,因其苯环上只有一个取代基,所以苯环含有三种环境的氢,且个数比为1:2:2,所以剩余的氢原子应为甲基上的氢原子,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为
=5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,因其苯环上只有一个取代基,所以苯环含有三种环境的氢,且个数比为1:2:2,所以剩余的氢原子应为甲基上的氢原子,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为![]() 。
。

练习册系列答案
相关题目
【题目】元素周期表中七个周期可填充的元素种类如下表所示:
周期数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
元素种类 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
(1)第6、7周期均比第4、5周期多了14种元素,其原因是__。
(2)周期表中__族所含元素最多。
(3)请分析周期数与元素种类的关系,可推测出第8周期可能含有的元素种类为__(填序号)。
A.18 B.32 C.50 D.64