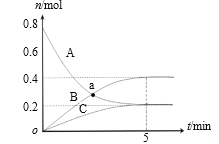
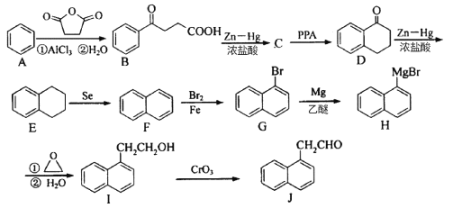
题目内容
【题目】如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):
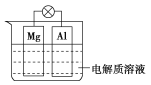
(1)电解质溶液为稀硫酸时,灯泡亮,Mg电极上发生的反应为____________________;Al电极上发生的反应为_____________________________。溶液中![]() 向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
向_____移动(填“Mg电极”或“Al电极”)。当电路中转移0.5 mol电子时,理论上消耗负极材料的质量为___ g。
(2)电解质溶液为NaOH溶液时,灯泡________(填“亮”或“不亮”,填“亮”做a题,填“不亮”做b题)。
a.若灯泡亮,Al电极上发生的反应为____________________________。
b.若灯泡不亮,其理由为________________________。
【答案】Mg-2e-=Mg2+ 2H++2e-=H2↑ 镁电极 6 亮 ![]() 无
无
【解析】
(1)电解质溶液为稀硫酸时,灯泡亮,形成原电池,镁比铝活泼,镁作负极,电极反应为Mg-2e-=Mg2+,铝作正极,电极反应为2H++2e-=H2↑,据此分析判断并计算解答;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于镁不能与氢氧化钠反应,而金属铝能与氢氧化钠溶液反应生成偏铝酸钠(或四羟基合铝酸钠)溶液和氢气,所以铝为负极,镁为正极,据此分析解答。
(1)电解质溶液为稀硫酸时,灯泡亮,形成原电池,镁比铝活泼,镁作负极,电极反应为Mg-2e-=Mg2+,铝作正极,电极反应为2H++2e-=H2↑,原电池中阴离子向负极移动,![]() 向镁电极移动,根据负极电极反应:Mg-2e-=Mg2+,消耗1mol镁,转移2mol电子,则转移0.5 mol电子时,消耗镁电极0.25mol,其质量为0.25mol×24g/mol=6g;
向镁电极移动,根据负极电极反应:Mg-2e-=Mg2+,消耗1mol镁,转移2mol电子,则转移0.5 mol电子时,消耗镁电极0.25mol,其质量为0.25mol×24g/mol=6g;
(2)金属镁和铝为电极材料,电解质溶液为稀NaOH时,由于镁不能与氢氧化钠反应,而金属铝能与氢氧化钠溶液反应生成偏铝酸钠(或四羟基合铝酸钠)溶液和氢气,所以铝为负极,镁为正极,该装置构成原电池,则灯泡亮,正极的电极反应为6H2O+6e-=3H2↑+6OH-,负极的电极反应为![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】下表为元素周期表的一部分,用请化学用语回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | E | F | ||||||
3 | A | C | D | G | R | |||
4 | B | H |
(1)C和H的元素符号是______和_______;
(2)表中A与F的氢化物反应的化学方程式___________,E的单质与其下一周期同族元素的最高价氧化物在高温下反应的化学方程式___________;最不活泼的元素________(填写元素符号)
(3)表中所列元素中最高价氧化物对应水化物碱性最强的是___________,酸性最强的是______ (填写化学式)
(4)表中能形成两性氢氧化物的元素是__________(填写元素符号),写出该元素的氢氧化物与A的最高价氧化物对应水化物反应的离子方程式__________________。