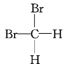
题目内容
【题目】将 N2、H2 的混合气体分别充入甲、乙、丙三个容器中,进行N2 + 3H2 ![]() 2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
2NH3的反应,测得反应速率分别为:甲:v(H2)=1 mol·L-1·min-1;乙:v(N2)=2 mol·L-1·min-1;丙:v(NH3)=3 mol·L-1·min-1。则三个容器中合成氨的反应速率
A.v(甲)>v(乙)>v(丙)B.v(乙)>v(丙)>v(甲)
C.v(丙)>v(甲)>v(乙)D.v(乙)>v(甲)>v(丙)
【答案】B
【解析】
同一化学反应中,同一时间段内,各物质的反应速率之比等于其化学计量数之比;先把不同物质的反应速率换算成同一物质的反应速率进行比较,从而确定选项。
合成氨反应为N2(g)+3H2(g)![]() 2NH3(g),以氢气的反应速率为标准进行判断。
2NH3(g),以氢气的反应速率为标准进行判断。
甲:v(H2)=1molL-1min-1;
乙:v(N2)=2molL-1min-1,反应速率之比等于其化学计量数之比,所以v(H2)=3v(N2)=6molL-1min-1;
丙:v(NH3)=3molL-1min-1,反应速率之比等于其化学计量数之比,所以v(H2)=1.5v(N2)=4.5molL-1min-1;所以反应速率v(乙)>v(丙)>v(甲);
答案为D。

练习册系列答案
相关题目