题目内容
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:

在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
【答案】 CO(g)+1/2O2(g)=CO2(g) ΔH=-283kJ/mol 该反应是吸热且熵增的反应,只有在较高温度下ΔG=ΔH-TΔS 才有可能小于0,反应才有利于自发进行 88.36∶55(或1.61∶1或8∶5) 0.025 < 不变 HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O
【解析】(1)①C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol,②2C(s)+O2(g)=2CO(g) △H=-221kJ/mol,根据盖斯定律,将(①×2-②)×![]() 得:CO(g)+ O2(g)=CO2(g)ΔH=[(-393.5kJ/mol)×2-(-221kJ/mol)]×
得:CO(g)+ O2(g)=CO2(g)ΔH=[(-393.5kJ/mol)×2-(-221kJ/mol)]×![]() =-283kJ/mol,故答案为:CO(g)+1/2O2(g)=CO2(g)ΔH=-283kJ/mol;
=-283kJ/mol,故答案为:CO(g)+1/2O2(g)=CO2(g)ΔH=-283kJ/mol;
(2)该反应是吸热反应,且属于熵增的反应,只有在较高温度下ΔG=ΔH-TΔS才有可能小于0,反应才有利于自发进行,因此气体通过微波催化交换炉需要较高温度,故答案为:该反应是吸热且熵增的反应,只有在较高温度下ΔG=ΔH-TΔS才有可能小于0,反应才有利于自发进行;
(3)含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64%,则H2约为1-55%-25%-15%-1.64%=3.36%,假设气体总量为100mol,经过脱氧后含有55mol N2,25molCO、15molCO2、3.36molH2,经过CO2+CH4![]() 2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O
2CO+2H2,反应后气体中含有55mol N2,(25+15×2)molCO、(15×2+3.36)molH2,再经过CO+H2O![]() CO2+ H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)= n(H2):n(N2)= (25+15×2+15×2+3.36)mol:55mol= 88.36∶55,故答案为:88.36∶55;
CO2+ H2反应后,气体中含有55mol N2,(25+15×2)molCO2、(25+15×2+15×2+3.36)molH2,因此V(H2):V(N2)= n(H2):n(N2)= (25+15×2+15×2+3.36)mol:55mol= 88.36∶55,故答案为:88.36∶55;
(4)10min内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡是c (ClNO)=7.5
10-3mol/(L·min),则平衡是c (ClNO)=7.5![]() 10-3mol/(L·min)×10min =0.075 mol/L,n (ClNO)= 0.075 mol/L×2L=0.15mol,根据2NO(g)+Cl2(g)
10-3mol/(L·min)×10min =0.075 mol/L,n (ClNO)= 0.075 mol/L×2L=0.15mol,根据2NO(g)+Cl2(g) ![]() 2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)= 0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变,故答案为:0.025;<;不变;
2ClNO(g),反应的氯气为0.075mol,则平衡后n(Cl2)= 0.1mol-0.075mol=0.025mol,由于该反应为气体体积减小的反应,若反应在恒压条件下进行,相当于平衡时增大压强,平衡正向移动,NO的转化率增大,即α1<α2;温度不变,平衡常数K不变,故答案为:0.025;<;不变;
(5)NCl3中Cl元素为+1价,NCl3发生水解产物之一具有强氧化性,为次氯酸,次氯酸能将稀盐酸中的NaClO2氧化成ClO2,反应的离子方程式为HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O,故答案为:HC1O+2C1O2-+H+=2ClO2↑+Cl-+H2O。

【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
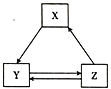
选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D




