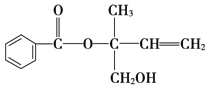
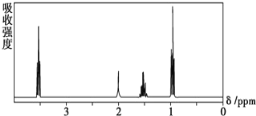
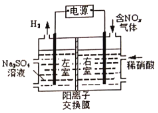
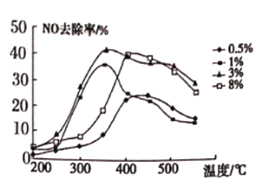
题目内容
【题目】已知:形成KBr晶体时的能量变化如图所示,下列说法正确的是
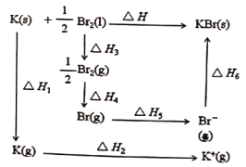
A.△H1<0,△H2<0
B.△H3-△H4<0
C.△H6=△H3+△H4+△H5-△H
D.△H=△H1+△H2-△H3-△H4-△H5-△H6
【答案】B
【解析】
A.物质由固态变为气态吸收能量,原子失去电子吸收能量;
B.物质由液态变为气态吸收能量,化学键断裂吸收的能量大于气化时吸收的能量;
C.根据盖斯定律进行计算;
D.根据盖斯定律进行计算
A. 物质由固态变为气态吸收能量ΔH1>0,原子失去电子吸收能量ΔH2>0,A项错误;
B. 物质由液态变为气态吸收能量,化学键断裂吸收的能量大于气化时吸收的能量,则有△H3-△H4<0,B项正确;
C.由盖斯定律有:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=ΔH,那么ΔH6=ΔH-ΔH1-ΔH2-ΔH3-ΔH4-ΔH5,C项错误;
D. 由盖斯定律有:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=ΔH,D项错误;
答案选B。

练习册系列答案
相关题目
【题目】今年是门捷列夫发现元素周期律150周年。下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)X元素的名称是______________。
(2)Y元素的氢化物H2Y的稳定性_____________(填“>”或“<”)H2S。
(3)表中元素的最高价氧化物对应的水化物酸性最强的是____________(填化学式)。
(4)写出W的最高价含氧酸的稀溶液与足量铁粉反应的离子方程式_____________。
(5)碳与镁可形成化合物M,若1molM与水反应生成2 mol Mg(OH)2和1mol烃N,N分子中碳氢质量比为9:1, M与水反应的化学方程式为___________。