题目内容
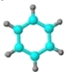
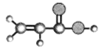
【题目】苯氧乙醇在化妆品、护肤品、疫苗及药品中发挥着防腐剂的功用,其结构为![]() ,下列有关说法不正确的是
,下列有关说法不正确的是
A.苯氧乙醇的分子式为C8H10O2
B.苯氧乙醇中的所有碳原子不可能处于同一平面内
C.苯氧乙醇既可以发生取代反应和加成反应,也可以使酸性高锰酸钾溶液褪色
D.分子式为C8H8O2,结构中含有苯环且能与饱和NaHCO3溶液反应的物质共有4种(不考虑立体异构)
【答案】B
【解析】
A.苯氧乙醇的不饱和度为4,则其分子式为C8H2×8+2-4×2O2,A正确;
B.苯氧乙醇中,苯氧基上的C、O原子一定在同一平面内,非羟基O原子与2个C原子可能在同一平面内,所以所有碳原子可能处于同一平面内,B不正确;
C.苯氧乙醇中的苯基可发生加成反应,醇羟基能发生取代反应、HOCH2-能使酸性高锰酸钾溶液褪色,C正确;
D.符合条件的有机物为![]() 、
、 共4种,D正确;
共4种,D正确;
故选B。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①能使溴的四氯化碳溶液褪色; ②比例模型为: ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: | 分子式为C2H6O,能与E酯化 | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: |
根据表中信息回答下列问题:
(1)A到E中,属于烃的是__________(填字母);写出A与溴水反应的化学方程式__________。
(2)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水小 ⑤可使酸性高锰酸钾溶液和溴水均褪色
(3)写出C、D 结构简式:__________、__________。
(4)E 中含氧官能团的名称__________。
【题目】现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B. c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中的 c(H+)/c(CH3COOH) 比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)______(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 | K1=1.54×10-2 K2=1.02×10-7 |
①下列微粒可以大量共存的是______![]() 填字母
填字母![]() 。
。
a.CO32-、HSO3- b.HCO3-、HSO3-
c.SO32-、HCO3- d.CO32- 、H2CO3
②写出下列反应的离子方程式:
H2SO3+Na2CO3(少量):_______________
室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
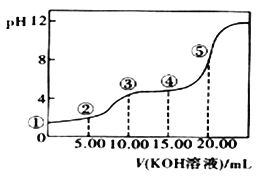
(5)点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=_____mol/L。点⑤所示的溶液中各离子浓度的大小顺序_____.
(6)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于锥形瓶中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是_______;该过程中发生反应的离子方程式为________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为________。
【题目】制造一次性医用口罩的原料之一丙烯是三大合成材料的基本原料,丙烷脱氢作为一条增产丙烯的非化石燃料路线具有极其重要的现实意义。丙烷脱氢技术主要分为直接脱氢和氧化脱氢两种。
(1)根据下表提供的数据,计算丙烷直接脱氢制丙烯的反应C3H8(g)![]() C3H6(g) +H2(g)的H=___。
C3H6(g) +H2(g)的H=___。
共价键 | C-C | C=C | C-H | H-H |
键能/(kJmol-1) | 348 | 615 | 413 | 436 |
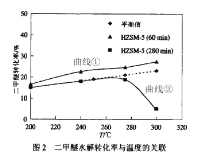
(2)下图为丙烷直接脱氢制丙烯反应中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中压强分别为1×104Pa和1×105Pa)
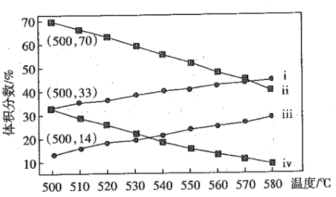
①在恒容密闭容器中,下列情况能说明该反应达到平衡状态的是__(填字母)。
A.H保持不变
B.混合气体的密度保持不变
C.混合气体的平均摩尔质量保持不变
D.单位时间内生成1molH-H键,同时生成1molC=C键
②欲使丙烯的平衡产率提高,下列措施可行的是____(填字母)
A.增大压强 B.升高温度 C.保持容积不变充入氩气
工业生产中为提高丙烯的产率,还常在恒压时向原料气中掺入水蒸气,其目的是_____。
③1×104Pa时,图中表示丙烷和丙烯体积分数的曲线分别是___、____(填标号)
④1×104Pa、500℃时,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,计算结果保留两位有效数字)
(3)利用CO2的弱氧化性,科学家开发了丙烷氧化脱氢制丙烯的新工艺,该工艺可采用铬的氧化物作催化剂,已知C3H8+CO2(g) C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。
C3H6(g)+CO(g)+H2O(l),该工艺可以有效消除催化剂表面的积炭,维持催化剂的活性,其原因是____,相对于丙烷直接裂解脱氢制丙烯的缺点是_____。