题目内容
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取Al2O3两种工艺的流程如下:
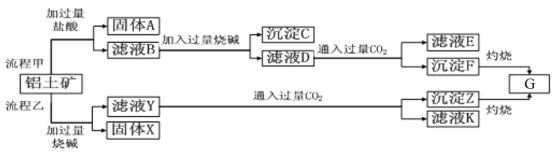
请回答下列问题:
(1)流程乙加入烧碱后和SiO2反应的离子方程式为________________________________。
(2)流程甲滤液D中通入过量CO2的化学方程式为_______________________________。
(3)验证滤液B中是否含有Fe3+的方法:_____________________________。
(4)写出滤液E中溶质的一种用途_________________________________。
(5)由物质G制取铝的化学方程式为__________________________。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移3mole-,有1.5mol化合物X生成,此反应的化学方程式________。
【答案】 SiO2+2OH-=SiO32-+H2O NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3 取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+ 制纯碱或做发酵粉等 2Al2O3![]() 4Al+3O2↑ Al2O3+N2+3C
4Al+3O2↑ Al2O3+N2+3C![]() 2AlN+3CO
2AlN+3CO
【解析】由工艺流程甲可知,铝土矿与盐酸反应得固体A、滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为A1(OH)3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为A1(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答。
(1)根据以上分析可知流程乙加入烧碱后和SiO2反应的离子方程式为SiO2+2OH-=SiO32-+H2O。
(2)流程甲滤液D中通入过量CO2生成氢氧化铝和碳酸氢钠,反应的化学方程式为NaA1O2+CO2+2H2O=A1(OH)3↓+NaHCO3。
(3)一般用KSCN溶液检验铁离子,则验证滤液B含Fe3+方法为取少量滤液B于试管中,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+;
(4)滤液E中含有NaCl、NaHCO3,碳酸氢钠可制纯碱或做发酵粉等。
(5)铝是活泼的金属,通过电解熔融的氧化铝制得,氢氧化铝受热分解生成G是氧化铝,则制备铝的方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。
(6)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X,根据元素守恒可知X中应含有氧元素和碳元素,已知每转移3mole-,有1.5mol化合物X生成,由电子转移守恒可得在X中C的化合价为3mol÷1.5mol=2,所以X是CO,因此该反应的化学方程式为Al2O3+N2+3C![]() 2AlN+3CO。
2AlN+3CO。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】已知E1=134kJ/mol、E2=368kJ/mol,请参考题中图表,按要求填空: 
(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,NO2和CO反应的热化学方程式为: .
(2)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用.目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应. 反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq)△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq)△H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq)△H3
则△H3与△H1、△H2之间的关系是:△H3= .
(3)下表所示是部分化学键的键能参数:
化学键 | P﹣P | P﹣O | O═O | P═O |
键能/(kJ/mol) | a | b | c | x |
已知白磷的燃烧热为d kJ/mol,白磷及其完全燃烧生成的产物的结构如图Ⅱ所示,表中x= kJ/mol(用含a、b、c、d的代数式表示).

