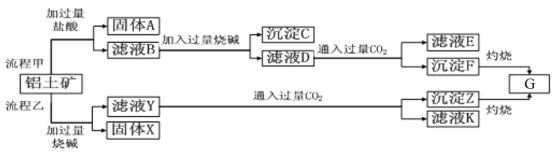
题目内容
【题目】氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN 度液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN 的电离常数Ka=62×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN 溶解于一定浓度的NaOH 溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_________________。
(3)系列操作B 为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移 向 催 化 剂___________(填“a”或“b”)。
②催化剂a 表面发生的反应为_____________________。
【答案】 抑制水解 碱 即水解平衡常数大于电离平衡常数,所以溶液呈碱性 相同温度下K4Fe(CN)6的溶解度小于Na4Fe(CN)6 过滤、洗涤、干燥 KFe[Fc(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq) b Fe(CN)64—e-=Fe(CN)63-
【解析】(1)①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是抑制水解; ②根据Kh=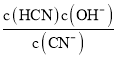 可知,Kh=
可知,Kh=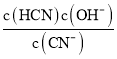 =
=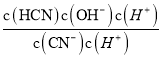 =
=![]() =
=![]() =1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性;(2) 相同温度下K4Fe(CN)6的溶解度小于Na4Fe(CN) 6,转化池中发生复分解反应Na4Fe(CN) 6+4KCl= K4Fe(CN)6↓+4NaCl生成K4Fe(CN)6;(3)转化池中得到固体与溶液的混合物,故系列操作B为过滤、洗涤、干燥;(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,治疗Tl2SO4中毒的离子方程式:KFe[Fc(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);(5)由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动。①b为正极,则K+移向催化剂b,故填b;②a为负极,发生氧化反应,则催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63-,故答案为:Fe(CN)64--e-═Fe(CN)63-。
=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性;(2) 相同温度下K4Fe(CN)6的溶解度小于Na4Fe(CN) 6,转化池中发生复分解反应Na4Fe(CN) 6+4KCl= K4Fe(CN)6↓+4NaCl生成K4Fe(CN)6;(3)转化池中得到固体与溶液的混合物,故系列操作B为过滤、洗涤、干燥;(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,治疗Tl2SO4中毒的离子方程式:KFe[Fc(CN)6](s)+Tl+(aq)=TlFe[Fe(CN)6](s)+K+(aq);(5)由图可知,电子从负极流向正极,则a为负极,b为正极,负极发生氧化反应,正极发生还原反应,阳离子向正极移动。①b为正极,则K+移向催化剂b,故填b;②a为负极,发生氧化反应,则催化剂a表面发生反应:Fe(CN)64--e-═Fe(CN)63-,故答案为:Fe(CN)64--e-═Fe(CN)63-。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】CO2既是温室气体,也是重要的化工原料,以CO2为原料可合成多种有机物。
(1)CO2可用于生产甲醇,已知:2CO2(g)+6H2(g) ![]() CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。
CH2=CH2(g)+4H2O(g) ΔH=QkJ/mol。一定条件下,按不同的投料比X(X=n(H2)/n(CO2))向某容积可变的恒压密闭容器中充入CO2、H2,测得不同投料比时CO2的转化率与温度的关系如图所示。

①X1_______X2(填“>”或“<”,后同),Q_______0。
②图中A、B、C三点对应的平衡常数KA、KB、KC的大小关系为______。
③TK时,在该容积可变的恒压密闭容器中发生上述反应,测得有关数据如下表所示:
物质的量(mol) 时间(min) | 0 | 5 | 10 | 15 | 20 |
H2(g) | 6.00 | 5.40 | 5.10 | 5.80 | 5.80 |
CO2(g) | 2.00 | 1.80 | 1.70 | 1.60 | 1.60 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 0.20 | 0.20 |
已知在10min时只改变了一个反应条件,用改变的条件可能是______。
④下列情况下能表明该反应达到平衡状态的是_____。
a.气体密度不变 b.混合气休的平均摩尔质量不变 c.消耗速率:2v(H2O)=v(CO2)
(3)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
① 若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=______ [常温下K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11]。
② 欲用5L Na2CO3溶液将23.3 g BaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________。[已知:常温下Ksp(BaSO4)=1×10-7、Ksp(BaCO3)=2.5×10-6]。(忽略溶液体积积的变化)