题目内容
(1)请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸四种酸氧化性相对强弱的实验中发生的有关问题:
分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生反应的是(填序号,下同)________,微热则发生反应的是________,加热后发生反应的是________,加热也不发生反应的是________。由此可以得到上述四种酸氧化性由强到弱的顺序是________。
(2)盐酸、硫酸是中学阶段常见的酸。请就其与金属铜反应的情况,回答下列问题:
①我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为
________________________________________________________________________。
②在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填“大于”“等于”或“小于”)100 mL。有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”)。
(1)③ ④ ① ② ③>④>①>②
(2)①Cu+H2O2+2HCl===CuCl2+2H2O
②大于 可行?
解析:
(1)比较不同物质氧化性强弱时,可利用同一种还原剂与它们反应时反应条件的难易进行比较。Cu与浓硝酸在常温下剧烈反应,Cu与稀硝酸不加热或微热时即可反应,Cu与浓硫酸需在加热条件下才能反应,Cu与稀硫酸加热也不反应。(2)H2O2具有较强氧化性,在酸性条件下可氧化单质铜,在酸性条件下,硝酸盐具有强氧化性,能使Cu与浓硫酸反应后剩余的铜片继续溶解。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 、
、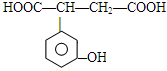 、
、