题目内容
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是( )
| A、标准状况下,1.12L的SO3所含的原子数约为0.2×6.02×1023 |
| B、1mol MgCl2中含有的离子数约为2×6.02×1023 |
| C、1.8g的NH4+离子中含有的电子数约为6.02×1023 |
| D、2.4g金属镁变为镁离子时失去的电子数约为0.1×6.02×1023 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、标准状况三氧化硫不是气体;
B、依据氯化镁电离生成镁离子和氯离子分析判断;
C、依据n
计算物质的量结合铵根离子计算电子数;
D、依据n
计算物质的量,结合镁原子失去2个电子生成镁离子计算判断;
B、依据氯化镁电离生成镁离子和氯离子分析判断;
C、依据n
| m |
| M |
D、依据n
| m |
| M |
解答:
解:A、标准状况三氧化硫不是气体,1.12L的SO3所物质的量不是0.05mol,故A错误;
B、依据氯化镁电离生成镁离子和氯离子分析,1mol MgCl2中含有的离子数约为3×6.02×1023,故B错误;
C、依据n
计算物质的量=
=0.1mol,结合铵根离子计算电子数=0.1mol×10×NA=6.02×1023,故C正确;
D、依据n
计算物质的量=
=0.1mol,结合镁原子失去2个电子生成镁离子计算,2.4g金属镁变为镁离子时失去的电子数约为0.1×2×6.02×1023,故D错误;
故选C.
B、依据氯化镁电离生成镁离子和氯离子分析,1mol MgCl2中含有的离子数约为3×6.02×1023,故B错误;
C、依据n
| m |
| M |
| 1.8g |
| 18g/mol |
D、依据n
| m |
| M |
| 2.4g |
| 24g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积的条件应用,主要微粒结构的理解应用,咋给我基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 |
| C、Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 |
| D、碳酸钠、氢氧化钡、氯化铵、过氧化钠都属于离子化合物 |
桶烯(Barrelene)结构简式如图所示,有关说法不正确的是( )
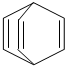

| A、桶烯分子中所有原子不可能在同一平面内 |
| B、桶烯在一定条件下能发生加成反应 |
| C、桶烯的分子式C8H8 |
| D、桶烯的一个氢原子被Cl取代,有四种结构 |
下列有关物质的性质或结构的说法正确的是( )
| A、1531P是一种广泛应用于含磷化合物的结构分析和医疗诊断的核素,其原子核内含有15个中子 |
| B、Cl与I同属于ⅦA族元素,则两者最高价氧化物对应水化物的酸性:HClO4<HIO4 |
| C、Li、Na、K、Rb、Cs都属于碱金属元素,它们单质的还原性随原子序数的增大而减弱 |
| D、Na的原子半径比Cl的大,但Na+的半径比Cl-的小 |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)的溶液 |
| C、滴加酚酞,颜色未变红的溶液 |
| D、酸与碱恰好完全反应生成正盐的溶液 |
下列离子方程式书写正确的是:( )
| A、AlCl3溶液与过量的浓氨水:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| B、向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、溴化亚铁溶液中通入足量的氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D、CuSO4溶液与少量的Ba(OH)2溶液:Cu2++SO42-+Ba2++2OH-=Cu(OH)2↓+BaSO4↓ |
下列反应的离子方程式肯定不正确的是( )
| A、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加Ba(OH)2溶液:NH4++Al3++2SO42+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O | ||||
| B、向FeBr2溶液中通人Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | ||||
| C、向含Mg(HCO3)2的硬水中滴加NaOH溶液:Mg2++HCO3-+OH-=MgCO3↓+H2O | ||||
D、用惰性电极电解金属氯化物溶液的离子方程式:2Cl-+2H2O
|
设NA为阿伏加德罗常数,下列说法不正确的是( )
| A、标准状况下C2H4气体22.4L,所含电子数为16NA |
| B、0.1mol铁在纯氧中充分燃烧,失电子数为0.3NA |
| C、1L 0.2mol/L的氯化铁溶液中,氯离子数为0.6NA |
| D、室温下,16g甲烷含有共价键数为4NA |