题目内容
20.某课外小组对一些金属单质和化合物的性质进行研究.(1)如表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验报告 | 实验现象 |
| 将打磨过的铝片过量放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色. |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色(视其主要成分为) |
| Cu2OH2CO3 |
置换反应2Al+3CuCl2=3Cu+2AlCl3,
化合反应2Cu+O2+CO2+H2O=Cu2(OH)2CO3.
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是有白色沉淀生成,后沉淀逐渐溶解至消失.解释此现象的离子方程式是Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(3)工业上可用铝与软锰矿?主要成分为MnO2?反应来冶炼金属锰.
①用铝与软锰矿冶炼锰的原理是?用化学方程式表示?3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3.
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
分析 (1)在金属活动性顺序中,铝排在铜的前面,故铝可以把氯化铜中的铜置换出来,得到的红色固体为铜,露置在空气中会与氧气、水、二氧化碳共同作用生成铜锈,其成分为碱式碳酸铜,此物质不稳定,受热易分解,根据这些知识就可以按要求写出有关反应的化学方程式.
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,为铝热反应;
②根据提供的反应物和产物及氧化还原反应可知Mn由+4价变为+2价,氧元素化合价肯定升高.
解答 解:(1)置换反应就是一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,将打磨过的铝片放入氯化铜溶液中,析出红色固体,说明铝与氯化铜反应,铜被置换出来,同时生成氯化铝,该反应为置换反应,化合反应就是由两种或两种以上的物质生成一种其他物质的化学反应,红色的铜放在潮湿的空气中变为绿色,是因为与氧气、二氧化碳、水共同作用生成了铜锈碱式碳酸铜,该反应为化合反应,
故答案为:2Al+3CuCl2=3Cu+2AlCl3;2Cu+O2+CO2+H2O=Cu2(OH)2CO3;
(2)实验分离出的溶液是氯化铝溶液,惰性电极电解阳极氯离子放电生成氯气,阴极氢离子放电生成氢气,附近氢氧根离子和铝离子反应生成氢氧化铝沉淀,随氢氧根离子浓度增大,氢氧化铝可以溶解于碱中,反应的离子方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:有白色沉淀生成,后沉淀逐渐溶解至消失;Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(3)①高温时,铝与二氧化锰发生置换反应生成锰,反应的方程式为3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3,故答案为:3MnO2+4Al$\frac{\underline{\;高温\;}}{\;}$3Mn+2Al2O3;
②根据氧化还原反应可知Mn由+4价变为+2价,氧化合价肯定升高,所以产物有氧气生成,反应为MnO2+H2O2+2H+═Mn2++O2↑+2H2O,
故答案为:MnO2+H2O2+2H+═Mn2++O2↑+2H2O.
点评 本题通过常见金属及其化合物化学性质的实验,考查了化学方程式的书写及电解原理的产物判断,完成此类题目,根据化学反应事实,写出符合题意的化学方程式,题目难度中等.

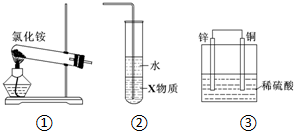
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是电解池,Cu上产生气泡 | |
| D. | 装置③是原电池,锌电极为阴极,发生氧化反应 |
| A. | 乙醛的分子式为CH3CHO | |
| B. | 苯、乙醇和乙酸都能发生取代反应 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
| A. | 汽油 | B. | 浓氨水 | C. | 乙醇 | D. | 溴苯 |
| 物质 | 试剂 | 分离方法 | |
| ① | 硝酸钾(氯化钠) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ①② | B. | ①④ | C. | ①③ | D. | ③④ |
| A. | 溴乙烷加氢氧化钠溶液加热后,再加AgNO3溶液有浅黄色沉淀生成 | |
| B. | 实验室用分液漏斗分离苯和溴苯的混合物 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,直至产生的沉淀恰好溶解为止 | |
| D. | 除去苯中的少量苯酚,可用先加浓溴水,充分沉淀后过滤即可 |
| A. | 金属材料都是导体,非金属材料都是绝缘体 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 水电站把机械能转化成电能,而核电站把化学能转化成电能 | |
| D. | 我国规定自2008 年6 月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染” |
| A. | 油脂的皂化反应属于取代反应 | |
| B. | 丁烷(C4H10)有两种同分异构体 | |
| C. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双键 | |
| D. | 以淀粉为原料可制取乙酸乙酯 |