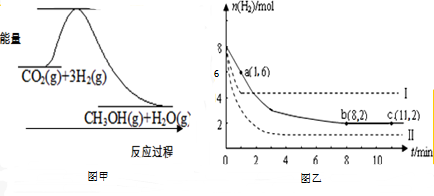
题目内容
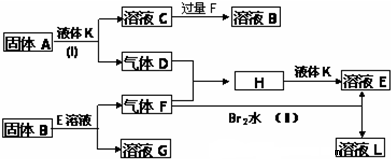
甲、乙、丙、丁四种短周期元素可以组成下列框图中除Br2和L以外的物质,其原子序数依次增大.甲和乙可形成常见液态化合物K,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丁元素原子的最外层电子数是其电子层数的2倍.在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出):
试回答:
(1)A的电子式为 ;所含化学键类型为 、 .
(2)溴元素在周期表的位置 丁元素的阴离子结构示意图为 .
(3)反应(I)的化学方程式为 .
(4)反应(II)的离子方程式为 .
(5)含1mol C的溶液中缓慢通入15.68L的CO2(标况),所得溶液中溶质的物质的量之比为 (式量大的比式量小的).
试回答:

(1)A的电子式为
(2)溴元素在周期表的位置
(3)反应(I)的化学方程式为
(4)反应(II)的离子方程式为
(5)含1mol C的溶液中缓慢通入15.68L的CO2(标况),所得溶液中溶质的物质的量之比为
考点:无机物的推断
专题:推断题
分析:甲和乙可形成常见液态化合物K,H溶于K中可得溶液,则K为H2O,根据原子序数可知甲为H元素,乙为O元素,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丙为Na元素,A为Na2O2,则C为NaOH,D为O2,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数比丙大,应为S元素,气体F能与溴水和氧气反应,说明具有还原性,应为SO2,和氧气反应生成SO3,则E为H2SO4,固体B应为Na2SO3,G为Na2SO4,L为HBr,结合对应物质的性质解答该题.
解答:
解:甲和乙可形成常见液态化合物K,H溶于K中可得溶液,则K为H2O,根据原子序数可知甲为H元素,乙为O元素,固体A中含有丙元素的正一价阳离子,其电子层结构与氖原子相同,丙为Na元素,A为Na2O2,则C为NaOH,D为O2,丁元素原子的最外层电子数是其电子层数的2倍,且原子序数比丙大,应为S元素,气体F能与溴水和氧气反应,说明具有还原性,应为SO2,和氧气反应生成SO3,则E为H2SO4,固体B应为Na2SO3,G为Na2SO4,L为HBr,
(1)A为Na2O2,为离子化合物,电子式为 ,含有离子键和共价键,
,含有离子键和共价键,
故答案为: ;离子键、共价键;
;离子键、共价键;
(2)溴的原子序数为35,原子核外有4个电子层,最外层电子数为7,位于周期表第四周期ⅦA族;
丁为S元素,对应阴离子核外由3个电子层,最外层电子数为8,离子的结构示意图为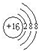 ,
,
故答案为:第四周期ⅦA族; ;
;
(3)反应(I)为Na2O2与H2O的反应,方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)SO2具有还原性,Br2具有氧化性,二者在溶液中发生氧化还原反应,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42--+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42--+2Br-.
(5)含1mol NaOH的溶液中缓慢通入15.68L的CO2(标况),二氧化碳的物质的量为
=0.7mol,n(CO2):n(NaOH)=0.7mol:1mol=7:10,介于1:2~1:1之间,故反应得到Na2CO3、NaHCO3,令二者物质的量分别x mol、ymol,根据钠离子守恒:2x+y=1,根据碳原子守恒:x+y=0.7,联立方程解得:x=0.3,y=0.4,故n(Na2CO3):n(NaHCO3)=0.3mol:0.4mol=3:4,
故答案为:n(Na2CO3):n(NaHCO3)=3:4.
(1)A为Na2O2,为离子化合物,电子式为
 ,含有离子键和共价键,
,含有离子键和共价键,故答案为:
 ;离子键、共价键;
;离子键、共价键;(2)溴的原子序数为35,原子核外有4个电子层,最外层电子数为7,位于周期表第四周期ⅦA族;
丁为S元素,对应阴离子核外由3个电子层,最外层电子数为8,离子的结构示意图为
 ,
,故答案为:第四周期ⅦA族;
 ;
;(3)反应(I)为Na2O2与H2O的反应,方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(4)SO2具有还原性,Br2具有氧化性,二者在溶液中发生氧化还原反应,反应的离子方程式为:SO2+Br2+2H2O=4H++SO42--+2Br-,
故答案为:SO2+Br2+2H2O=4H++SO42--+2Br-.
(5)含1mol NaOH的溶液中缓慢通入15.68L的CO2(标况),二氧化碳的物质的量为
| 15.68L |
| 22.4L/mol |
故答案为:n(Na2CO3):n(NaHCO3)=3:4.
点评:本题考查无机物的推断,题目难度中等,推断丙、丁元素是关键,再结合转化关系进行推断,注意相关元素化合物的性质.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
欧盟正考虑在欧盟范围内全面禁止使用塑料袋.下列有关说法正确的是( )
| A、塑料垃圾可直接露天焚烧 |
| B、实施“禁塑令”有助于遏制白色污染 |
| C、纤维素、油脂、蛋白质均属于有机高分子 |
D、聚丙烯结构式为: |
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B、Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
| C、向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
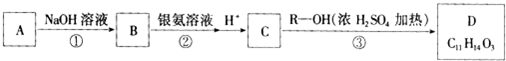 C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为
C在一定条件下可发生反应,生成一种高分子化合物E,E的结构简式为 ,其中R、R′为烃基.请回答以下问题:
,其中R、R′为烃基.请回答以下问题: ,且属于酯的所有同分异构体的结构简式
,且属于酯的所有同分异构体的结构简式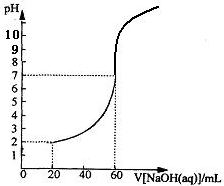 20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)