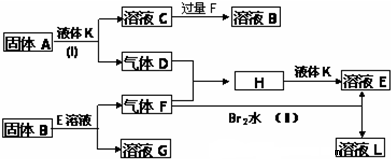
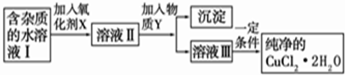
题目内容
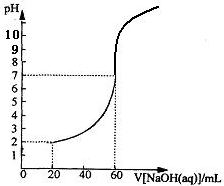 20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)(1)X、Y的物质的量浓度之比为
(2)盐酸的物质的量浓度为
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)氢氧化钠与氯化氢都是强电解质,当加入60mL氢氧化钠溶液时溶液的pH=7,说明恰好与20mL的盐酸反应,据此可以计算出盐酸与氢氧化钠溶液的浓度之比;
(2)根据图象可知,加入20mL氢氧化钠溶液时,溶液的pH=2,结合盐酸与氢氧化钠溶液的浓度之比列式计算出二者的浓度即可.
(2)根据图象可知,加入20mL氢氧化钠溶液时,溶液的pH=2,结合盐酸与氢氧化钠溶液的浓度之比列式计算出二者的浓度即可.
解答:
解:(1)根据图象可知,当NaOH溶液体积为60mL时,两溶液恰好反应,设盐酸的体积为x,氢氧化钠溶液的体积为y,则一定满足:0.02L×x=0.06×y,则X、Y的物质的量浓度之比为:x:y=0.06:0.03=3:1,
故答案为:3:1;
(2)设氢氧化钠溶液的浓度为c,则盐酸的浓度为3c,
根据图象可知,加入20mL氢氧化钠溶液时,混合液的pH=2,溶液中氢离子浓度为0.01mol/L,
则:
=0.01mol/L,
解得:c=0.01mol/L,
即:氢氧化钠溶液的浓度为0.01mol/L,盐酸的浓度为0.03mol/L,
故答案为:0.03mol/L.
故答案为:3:1;
(2)设氢氧化钠溶液的浓度为c,则盐酸的浓度为3c,
根据图象可知,加入20mL氢氧化钠溶液时,混合液的pH=2,溶液中氢离子浓度为0.01mol/L,
则:
| 0.02L×3c-0.02Lc |
| 0.02L+0.02L |
解得:c=0.01mol/L,
即:氢氧化钠溶液的浓度为0.01mol/L,盐酸的浓度为0.03mol/L,
故答案为:0.03mol/L.
点评:本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱混合的定性判断方法,明确溶液的酸碱性与溶液pH的关系,正确分析滴定曲线为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| B、可溶性碳酸盐溶浸石膏矿:CaSO4+CO32-?CaCO3+SO42- |
| C、向溴化亚铁溶液中通入过量氯气:Fe2++2Br-+2Cl2═Fe3++Br2+4Cl- |
| D、Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |