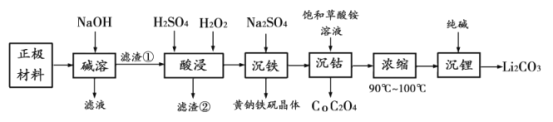
题目内容
【题目】室温下,某同学进行CO2与Na2O2反应的探究实验,回答下列问题。
(1)用如图装置制备纯净的CO2
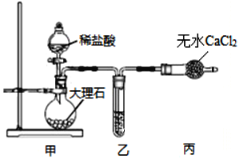
①甲装置中盛放稀盐酸的仪器名称是_____,乙装置中应加入的试剂是_______________。
②装置甲中反应的离子方程式为__________。
(2)按照下面的装置图进行实验(夹持装置略)。
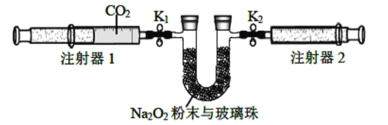
①先组装仪器,然后_______________,再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞,可观察到的现象是_______________。
③实验过程中,需缓慢推入CO2,其目的是________________,反应的化学方程式为_______________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体体积为65 mL,则反应消耗CO2的体积是________________。
【答案】分液漏斗 饱和NaHCO3溶液 CaCO3+2H+=Ca2++H2O + CO2↑ 检查装置的气密性 固体由淡黄色渐渐变为白色,注射器2中活塞向外移动 使CO2充分反应 2Na2O2+2CO2=2NaCO3+O 70mL
【解析】
(1)甲装置中大理石和稀盐酸反应生成二氧化碳,乙中装的是饱和NaHCO3溶液,除去二氧化碳中的HCl气体,丙中无水氯化钙干燥二氧化碳;
(2)用注射器1推进二氧化碳到U形管中,将二氧化碳与过氧化钠充分反应,生成碳酸钠和氧气。
(1)①甲装置中盛放稀盐酸的仪器名称为:分液漏斗;乙中装的是饱和NaHCO3溶液,除去二氧化碳中的HCl气体,故答案为:分液漏斗;饱和NaHCO3溶液;
②装置甲是实验室制备二氧化碳的发生装置,其反应的离子方程式为:CaCO3+2H+=Ca2++H2O + CO2↑,故答案为CaCO3+2H+=Ca2++H2O + CO2↑。
(2)①先组装仪器,然后检查装置的气密性,再用注射器1 抽取100 mL 纯净的CO2,将其连接在K1处,注射器2 的活塞推到底后连接在K2处,具支U 形管中装入足量的Na2O2粉末与玻璃珠,故答案为:检查装置气密性;
②二氧化碳与过氧化钠反应生成碳酸钠和氧气,则U形管中的过氧化钠淡黄色粉末逐渐变为白色,生成的氧气进入注射器2中,所以注射器2的活塞向外移动,故答案为:固体由淡黄色渐渐变为白色,注射器2中活塞向外移动;
③实验过程中,需缓慢推入CO2,其目的是使反应进行得更充分,反应的化学方程式为:2Na2O2+2CO2=2NaCO3+O,故答案为:使CO2充分反应;2Na2O2+2CO2=2NaCO3+O;
(3)开始抽取的二氧化碳的体积为100mL,实验结束后,测得注射器2中气体体积为65 mL,则气体体积减小了35mL,根据反应方程式:2Na2O2+2CO2=2Na2CO3+O2,则反应消耗CO2的体积为:70mL,则答案为:70mL。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案