题目内容
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
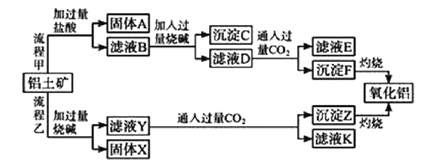
请回答下列问题:
(1)固体A的主要成分是______________(写名称)。
(2)铝土矿与过量烧碱反应的离子方程式为______________、________________。
(3)滤液D中的溶质有______________(填化学式)。
(4)指出流程乙的一个缺点是____________。
(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X。已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式___。
【答案】二氧化硅 Al2O3+2OH-=2AlO2-+ H2O SiO2+2OH- =SiO32-+H2O NaCl、NaOH、NaAlO2 氧化铝中含有二氧化硅杂质 Al2O3+N2+3C![]() 2AlN+3CO
2AlN+3CO
【解析】
由工艺流程甲可知,铝土矿与盐酸反应得固体A和滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠和过量的氢氧化钠,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,由此解答。
(1)铝土矿的主要成分是Al2O3,含SiO2、Fe2O3、MgO,只有SiO2不溶于盐酸,故A为SiO2,名称是二氧化硅;
(2)铝土矿的主要成分是Al2O3,含SiO2、Fe2O3、MgO,其中Al2O3和SiO2能够和氢氧化钠反应,反应的离子方程式分别为:Al2O3+2OH-=2AlO2-+ H2O和SiO2+2OH- =SiO32-+H2O;
(3)由分析可知,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含NaCl、NaAlO2和过量的NaOH;
(4)由分析可知,X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸。灼烧沉淀Z,氢氧化铝分解成氧化铝,硅酸加热分解会生成二氧化硅,故生成的氧化铝中含有二氧化硅杂质;
(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X,根据元素守恒可知X中应含有氧元素和碳元素,已知每转移6.02×1023个电子即1mol电子,有0.5mol化合物X生成,由电子转移守恒,可得在X中C的化合价为![]() =2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C
=2,所以X是CO,所以该反应的化学方程式为Al2O3+N2+3C ![]() 2AlN+3CO,故答案为:Al2O3+N2+3C
2AlN+3CO,故答案为:Al2O3+N2+3C ![]() 2AlN+3COAl2O3+N2+3C。
2AlN+3COAl2O3+N2+3C。

【题目】用如图中装置进行实验,实验一段时间后,现象与预测不一致的是
①中物质 | ②中物质 | 实验预测 | |
A | 浓氨水 | 酚酞试液 | ②中溶液变为红色 |
B | 浓硝酸 | 淀粉KI溶液 | ②中溶液变为蓝色 |
C | 浓盐酸 | 浓氨水 | 大烧杯中有白烟 |
D | 饱和的亚硫酸溶液 | 稀溴水 | ②中无明显变化 |
A. AB. BC. CD. D