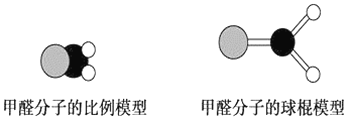
题目内容
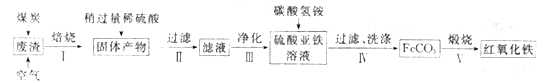
【题目】五氧化二钒及其他钒的化合物广泛应用于钢铁、有色合金、化工、炼油、玻璃及陶瓷等工业部门。可从含钒石煤灰渣中提钒,该试验工艺流程如下图:

表1 灰渣主要化学成分分析/%
V2O3 | SiO2 | Fe2O3 | Al2O3 | MgO | K2O | CaO | 烧失量 |
1.26 | 55.71 | 6.34 | 7.54 | 1.26 | 3.19 | 1.41 | 20.55 |
表2中间盐主要成分分析/%(以氧化物形式表示其含量)
V2O3 | Al2O3 | Fe2O3 | MgO | K2O |
5.92 | 1.70 | 18.63 | 2.11 | 3.38 |
已知:
①石煤灰渣的化学成分分析见表1,中间盐的主要成分分析见表2。
②矿物焙烧过程中,若温度过高,易发生烧结,温度越高,烧结现象越严重。
③萃取反应可以表示为:VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+,(o)表示有机相
④有机萃取剂(HR2)PO4萃取VO2+的能力比萃取V02+要强。
请回答:
(1)提高浸取率的方法有____________,残渣的主要成分为______________________,
(2)经几级萃取后,有时候要适当加酸调整pH值,结合萃取反应方程式,说明原因_____________。反萃取操作应加入_____________试剂。
(3)中间盐溶解过程中,加铁粉的主要目的是_____________________。
(4)石煤中的钒以V(Ⅲ)为主,有部分V(Ⅳ),很少见V(Ⅴ)。如图1和如图2分别为焙烧温度和焙烧时间对钒浸出率的影响,由如图2可得最佳焙烧时间为______________h,由如图1可得最佳焙烧温度为800-850℃之间,焙烧温度在850℃以下时,钒浸出率随焙烧温度的上升几乎直线上升的原因是_________________________,当焙烧温度高超过850℃以后,再提高温度,浸出率反而下降的可能原因是:_________________________。

(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,请写出该反应的离子方程式______________。然后用氨水调节pH到1.9~2.2沉钒,得多钒酸铵沉淀(化学式为(NH4)2V12O31·nH2O),再经固液分离、干燥、焙烧得五氧化二钒产品,请写出此步反应的化学方程式____________________________。
【答案】加热,提高酸的浓度,粉碎等 SiO2 随着萃取过程的进行,水相中的pH值有所下降,所以经几级萃取后需要调整pH值 H2SO4溶液 将VO2+还原为VO2+ 1.5-2.0之间 850℃以前,随着焙烧温度的升高,反应速率加快,生成的高价钒化合物更多,因此浸出率上升。 850℃以后,样品发生烧结,温度越高,烧结现象越严重,从而使钒的浸出率下降。 3H2O+6VO2++ClO3-=Cl-+6VO2++6H+ (NH4)2V12O31·nH2O![]() 6V2O5+2NH3↑+(n+1)H2O
6V2O5+2NH3↑+(n+1)H2O
【解析】
(1)结合提高产率或原料利用率的角度分析;二氧化硅不溶于硫酸;
(2)结合萃取反应分析萃取后水相的pH值变化;反萃取操作是使该萃取反应平衡向逆反应方向移动;
(3)结合已知信息④分析,铁粉具有还原性;
(4)结合图像分析作答;850℃以前,温度可影响化学反应速率和原料利用率,提高浸出率;850℃以后结合给定信息②进行解答;
(5)依据氧化还原反应的规律书写该反应的离子方程式;铵盐焙烧过程中有氨气生成,根据题意分析作答。
(1)加热,提高酸的浓度,粉碎等均可提高浸取率;加硫酸酸浸后,二氧化硅不反应,则残渣的主要成分为SiO2,
故答案为:加热,提高酸的浓度,粉碎等;SiO2;
(2)萃取反应根据VO2++(HR2)PO4(o)→VO[R2PO4]R(o)+H+可知,随着萃取过程的进行,水相中的氢离子浓度不断增大,pH值有所下降,所以经几级萃取后需要调整pH值,反萃取时,可加入适量硫酸溶液,使平衡向逆向移动,达到反萃取的目的,
故答案为:随着萃取过程的进行,水相中的pH值有所下降,所以经几级萃取后需要调整pH值 H2SO4溶液;
(3)由已知信息④可知,有机萃取剂(HR2)PO4萃取VO2+的能力比萃取VO2+要强,所以在中间盐溶液过程中,加入还原剂铁粉,可将VO2+还原为VO2+,提高原料利用率,便于后续萃取操作,
故答案为:将VO2+还原为VO2+;
(4)图2可得浸出率随着焙烧时间呈增大趋势,其最佳焙烧时间在1.5-2.0 h之间均可;浸出率随温度的变化曲线如图1,其原因是,850℃以前,随着焙烧温度的升高,反应速率加快,生成的高价钒化合物更多,因此浸出率上升;850℃以后,样品发生烧结,温度越高,烧结现象越严重,从而使钒的浸出率下降,
故答案为:1.5-2.0之间;850℃以前,随着焙烧温度的升高,反应速率加快,生成的高价钒化合物更多,因此浸出率上升;850℃以后,样品发生烧结,温度越高,烧结现象越严重,从而使钒的浸出率下降;
(5)反萃取液中的VO2+,加入氯酸钠后被氧化为VO2+,则NaClO3被还原为Cl-,根据得失电子守恒、电荷守恒、原子守恒,反应的离子方程式为6VO2++ClO3-+3H2O=6VO2++Cl-+6H+;(NH4)2V12O31·nH2O再经固液分离、干燥、焙烧得五氧化二钒产品,同时会有氨气与水生成,其化学方程式为:(NH4)2V12O31·nH2O![]() 6V2O5+2NH3↑+(n+1)H2O,
6V2O5+2NH3↑+(n+1)H2O,
故答案为:6VO2++ClO3-+3H2O=6VO2++Cl-+6H+;(NH4)2V12O31·nH2O![]() 6V2O5+2NH3↑+(n+1)H2O。
6V2O5+2NH3↑+(n+1)H2O。

 备战中考寒假系列答案
备战中考寒假系列答案