题目内容
铁盐在工业、农业、医药等领域有重要的价值。
(1)将55.600g绿矾(FeSO4?7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为 g;SO2为 mol。
(2)实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O,式量为392]。
Ⅰ.将4.400g铁屑(含Fe2O3)与25mL3mol/L H2SO4充分反应后,得到 FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1。
①铁屑中Fe2O3的质量分数是 (保留两位小数)。
Ⅱ.向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g。
②t℃时,(NH4)2SO4·FeSO4·6H2O的溶解度是 g/100g水(保留两位小数)。
(3)黄铁矾是难溶于水且不含结晶水的盐,它由两种阳离子和两种阴离子构成。工业上常用生成黄铁矾的方法除去溶液中的Fe2+,原理是:用氧化剂将Fe2+氧化为Fe3+,Fe3+的水解产物与溶液中某些离子一起生成黄铁矾沉淀。
实验室模拟工业过程的操作如下:
向1L 0.0500mol/L的稀硫酸中加入16.680g绿矾,完全溶解后,依次加入1.065gNaClO3(式量106.5)和1.610gNa2SO4?10H2O(式量322),充分反应后,得到9.700g黄铁矾沉淀。所得无色溶液中含有的H+为0.16 mol,SO42—为0.075 mol,Cl—为0.01mol。
计算并确定黄铁矾的化学式。
(1)16(3分);0.1(3分)
(2)①0.36(或36%)(3分) ②22.51(3分)
(3)NaFe3(SO4)2(OH)6(4分)
解析试题分析:
(1)绿矾(FeSO4?7H2O,式量为278)在高温下加热分解的方程式为2FeSO4?7H2O==Fe2O3+SO2+SO3+7H2O,设生成氧化铁的质量是x,二氧化硫的物质的量为y,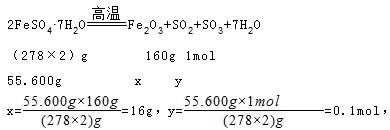
Ⅰ、根据题意知,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×0.5×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol,设铁的物质的量是m,氧化铁的质量是n,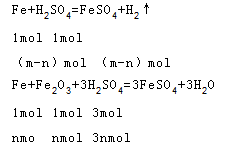
(SO4)2(OH)6.
考点:本题涉及物质的量、质量分数等有关计算,难度较大,注意Ⅰ、(1)中铁不仅和稀硫酸反应,还和铁离子反应,往往容易漏掉该反应而导致错误,为易错点.

下列每组中的两种互为同素异形体的是
| A.金刚石与石墨 | B.CH4与CH3CH3 |
| C.正丁烷与异丁烷 | D.12C与14C |
 4NO+6 H2O,4NO+3O2+2H2O
4NO+6 H2O,4NO+3O2+2H2O 4HNO3
4HNO3