��Ŀ����
����Ŀ���ﶬ���������߷��ļ�������������β����ȼúβ����������_����Ҫԭ��֮һ��
��1����ҵ�����ü������ԭNO���ɼ��ٵ���������ŷš�
��֪��CH4(g)+4NO2(g)=-4NO(g)+CO2(g)+2H2O(g) ��H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ��H=-1160kJ/mol
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ_____________��
��2������β���������ǿ�������β���ŷš���������β����Ⱦ������Ч���ֶΣ���Ҫԭ��Ϊ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H<0
N2(g)+2CO2(g) ��H<0
��һ�������µĺ������������г���NO��CO���ô�������ø÷�Ӧ�ڲ�ͬʱ��ʱNO��CO��Ũ�����±���ʾ��
ʱ��/s | 0 | 1 | 2 | 3 | 4 |
c(NO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
c(CO)/mol/L | 9.00��10-3 | 4.00��10-3 | 2.00��10-3 | 1.00��10-3 | 1.00��10-3 |
�����п��жϷ�Ӧ�ﵽƽ��״̬����___________(����ĸ����)��
A.c(NO)���ٸı� B.c(NO)/c(CO)���ٸı�
C.c(NO)/c(CO2)���ٸı� D.V(NO)=V(CO)
���������´ﵽƽ��ʱ���÷�Ӧ��ƽ�ⳣ��K=________��
��Ϊ�����β��������Ч�����ɲ�ȡ�Ĵ�ʩ��________(д�����ּ���)��
��3����ҵ�ϳ�����������Һ�������ķ�����ͬʱ����SO2���͵�������������(NOx)����������������Һ���տɵõ�Na2SO3��NaHSO3��NaNO2��NaNO3����Һ����֪:��������HNO2�ĵ��볣��ΪKa=7��10-4��H2SO3�ĵ��볣��ΪKa1=1.2��10-2��Ka2=5.8��10-8��
�������£���ͬŨ�ȵ�Na2SO3��NaNO2��Һ��pH�ϴ����______��Һ��
���������� NaHSO3��___�� (�������������������������жϵ�������(ͨ������˵��)______��
��4����Ԫ��(Ce)����ϵ��������Ȼ�����ߵ�һ����������+3��+4���ּ�̬�������к��д�������Ⱦ��NO�����Ա���Ce4+����Һ����������NO2-��NO3-���������ʵ���֮��Ϊ1:1)���ɲ��õ�ⷨ����������Һ�е�NO2-ת��Ϊ��������ͬʱ����Ce4+����ԭ������ͼ��ʾ��
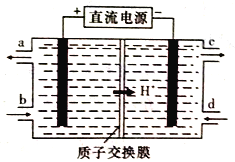
��Ce4+�ӵ��۵�_____(����ĸ����)��������
��д�������ĵ缫��Ӧʽ��______________��
���𰸡� CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=һ867kJ/mol AC 2.56��105 �����¶ȣ�������ѹǿ(��ѹ�����)����ʹ�ô����Ը��õĴ�����(д�����ּ���) Na2SO3 �� ��ΪHSO3-�ĵ��볣��Ka2=5.8��10-8��ˮ�ⳣ��Kb=![]() ��8.3��10-13�����볣������ˮ�ⳣ����������Һ������ a 2NO2-+8H++6e-=N2��+4H2O
��8.3��10-13�����볣������ˮ�ⳣ����������Һ������ a 2NO2-+8H++6e-=N2��+4H2O
��������������Ҫ�����й�ƽ��״̬���жϺͼ��㡣
��1������֪�������Ȼ�ѧ����ʽ����ٳ���2�ɵü���ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪCH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ��H=һ867kJ/mol��
��2����A.c(NO)���ŷ�Ӧ���ж��ı䣬��c(NO)���ٸı�ʱ��˵����Ӧ�ﵽƽ��״̬����A���жϷ�Ӧ�ﵽƽ��״̬��B.c(NO)/c(CO)��ƽ��״̬֮��û��һ����ϵ����B�����жϷ�Ӧ�ﵽƽ��״̬��C.c(NO/c(CO2)���ŷ�Ӧ���ж��ı䣬��c(NO/c(CO2)���ٸı�ʱ��˵����Ӧ�ﵽƽ��״̬����C���жϷ�Ӧ�ﵽƽ��״̬��D.V(NO)��V(CO)��������Ӧ���ʣ�����˵������Ӧ���ʵ����淴Ӧ���ʣ���D�����жϷ�Ӧ�ﵽƽ��״̬����ѡAC��
�ڴ������´ﵽƽ��ʱ��c(NO)=1.00��10-3mol/L��c(CO)=1.00��10-3mol/L��c(CO2)=8.00��10-3mol/L��c(N2)=4.00��10-3mol/L���÷�Ӧ��ƽ�ⳣ��K= 2.56��105��
2.56��105��
��Ϊ�����β��������Ч�����ɲ�ȡ�Ĵ�ʩ�н����¶ȣ�������ѹǿ(��ѹ�����)����ʹ�ô����Ը��õĴ�����
��3���ٳ����£�HNO2�ĵ��볣��Ka=7��10-4>H2SO3�ĵ��볣��Ka2=5.8��10-8��������ͬŨ�ȵ�ˮ��̶�Na2SO3>NaNO2��pH�ϴ����Na2SO3��Һ��
�ڳ����£�NaHSO3�����ԣ��жϵ���������ΪHSO3-�ĵ��볣��Ka2=5.8��10-8��ˮ�ⳣ��Kb=![]() ��8.3��10-13�����볣������ˮ�ⳣ����������Һ��������
��8.3��10-13�����볣������ˮ�ⳣ����������Һ��������
��4����Ce4+������������������ɣ��ӵ��۵�a��������
������������ԭ��Ӧ��������NO2-ת��ΪN2�������ĵ缫��Ӧʽ��2NO2-+8H++6e-=N2��+4H2O��

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�