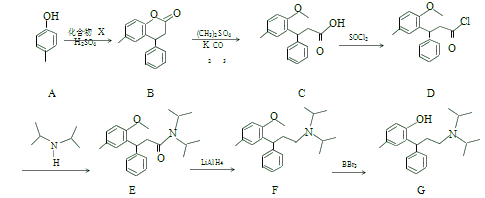
题目内容
【题目】研究 CO、CO2 的回收利用既可变废为宝,又可减少碳的排放。回答下列问题:
(1)T1 K 时,将 1mol 二甲醚引入一个抽空的 50L 恒容容器中,发生分解反应:CH3OCH3(g) ![]() CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:
CH4(g)+H2(g)+CO(g) ,在不同时间测定容器内的总压,所得数据见下表:

由表中数据计算:0~5.0 min 内的平均反应速率 v(CH3OCH3)=__________,该温度下平衡常数 K=_______________ 。
(2)在 T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g) ![]() CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,
CH3CHO(g),反应速率 v正 v逆=k正p(CO)p (CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,P为气体的分压(气体分压P=气体总压 P总×体积分数)。用气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,则 CO 转化率为 20%时,![]() =____________。
=____________。
【答案】![]()
![]() 0.8
0.8
【解析】
⑴由表中数据计算,压强之比等于物质的量之比,建立三段式计算得到消耗的CH3OCH3的物质的量,再计算其平均反应速率,再建立平衡时三段式并计算该温度下平衡常数;
⑵根据υ正= υ逆和气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,得到![]() ,再建立三段式根据公式进行计算
,再建立三段式根据公式进行计算![]() 。
。
⑴由表中数据计算,压强之比等于物质的量之比,假设0~5.0 min 内二甲醚消耗xmol, ,则有
,则有![]() ,解得x = 0.05mol,0~5.0 min 内CH3OCH3的平均反应速率
,解得x = 0.05mol,0~5.0 min 内CH3OCH3的平均反应速率 ![]() ,该温度下达到平衡常数时
,该温度下达到平衡常数时 ,
,![]() ,解得y = 0.75,
,解得y = 0.75,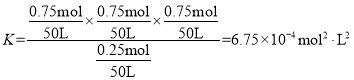 ,故答案为:
,故答案为:![]() ;
;![]() ;
;
⑵υ正= υ逆,即k正p(CO)p (CH4) = k逆p(CH3CHO),气体分压表示的平衡常数 Kp=4.5×10-5(kPa)-1,即得 ,在T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g)
,在T2 K、1.0×104 kPa 下,等物质的量的 CO 与 CH4 混合气体发生如下反应:CO(g)+CH4(g) ![]() CH3CHO(g),设开始时n(CO)=n(CH4)=1mol,则CO转化率为20%时,
CH3CHO(g),设开始时n(CO)=n(CH4)=1mol,则CO转化率为20%时,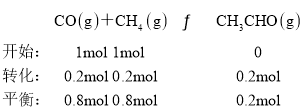 ,
, ,故答案为:0.8。
,故答案为:0.8。