题目内容
有X、Y、Z、W四种短周期元素,原子序数依次增大,其核电荷总数为36.Y元素原子最外层电子数占其核外电子总数的3/4,W元素原子最外层电子比同周期Z元素多5个电子,W和Y属于同一主族.
(1)写出元素符号:X
(2)Z、W两元素的最高价氧化物对应水化物反应的离子方程式是
(1)写出元素符号:X
H
H
YO
O
ZNa
Na
WS
S
.(2)Z、W两元素的最高价氧化物对应水化物反应的离子方程式是
H++OH-=H2O
H++OH-=H2O
.分析:X、Y、Z、W四种短周期元素,原子序数依次增大,Y元素原子最外层电子数占核外总电子数的
,设Y为第二周期,且最外层电子数为x,则
(2+x)=x,解得x=6,符合题意,则Y为O元素;W和Y属于同一主族,则W为S元素;W元素原子最外层电子比同周期Z元素多5个电子,则Z最外层电子数为6-5=1,Z的原子序数介于氧元素与硫元素之间,则Z为Na元素;X、Y、Z、W四种短周期元素,其核电荷总数为36,则A的核电荷数为36-8-11-16=1,所以A为H元素.
| 3 |
| 4 |
| 3 |
| 4 |
解答:解:、Y、Z、W四种短周期元素,原子序数依次增大,Y元素原子最外层电子数占核外总电子数的
,设Y为第二周期,且最外层电子数为x,则
(2+x)=x,解得x=6,符合题意,则Y为O元素;W和Y属于同一主族,则W为S元素;W元素原子最外层电子比同周期Z元素多5个电子,则Z最外层电子数为6-5=1,Z的原子序数介于氧元素与硫元素之间,则Z为Na元素;X、Y、Z、W四种短周期元素,其核电荷总数为36,则A的核电荷数为36-8-11-16=1,所以A为H元素.
(1)由上述分析可知,X为H元素,Y为O元素,Z为Na元素,W为S元素.
故答案为:H;O;Na;S.
(2)Z为Na元素,最高价氧化物对应水化物为NaOH,W为S元素,最高价氧化物对应水化物为H2SO4,反应方程式为2NaOH+H2SO4═Na2SO4+2H2O,反应离子方程式为H++OH-=H2O.
故答案为:H++OH-=H2O.
| 3 |
| 4 |
| 3 |
| 4 |
(1)由上述分析可知,X为H元素,Y为O元素,Z为Na元素,W为S元素.
故答案为:H;O;Na;S.
(2)Z为Na元素,最高价氧化物对应水化物为NaOH,W为S元素,最高价氧化物对应水化物为H2SO4,反应方程式为2NaOH+H2SO4═Na2SO4+2H2O,反应离子方程式为H++OH-=H2O.
故答案为:H++OH-=H2O.
点评:本题以元素推断为载体,考查原子结构与位置关系、化学用语,难度不大,元素的推断是解答的关键,注意运用计算推断.

练习册系列答案
相关题目

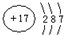

 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: