题目内容
(7分)在某温度下合成氨:N2+3H2 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:[来源:ZXXK]
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:[来源:ZXXK]
(1)写出该反应的平衡常数表达式:_____________,KA______KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占的比例较大。
|
|
容器A |
容器B |
|
M(平) |
20 |
|
|
平衡时N2的转化率 |
|
10%[来源:] |
【答案】
(1)K=c2 (NH3) /[c(N2) c3 (H2)],KA=KB。(2)C。(3)B。(4)25%,16.7,A。
【解析】

练习册系列答案
相关题目
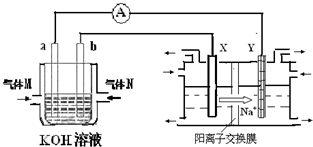 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料. 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.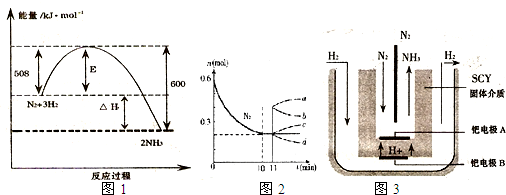

 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1