题目内容
【题目】Ⅰ.现有下列十种物质:①Cl2 ②钠 ③醋酸(CH3COOH) ④CO2 ⑤H2SO4 ⑥熔融KNO3 ⑦氨水 ⑧稀硝酸 ⑨Al2(SO4)3固体 ⑩NaHCO3,回答下列问题:
(1)属于电解质且能导电是____________(填序号)。
(2)写出①与水反应的化学方程式_____________________________。
(3)写出⑩溶于水时的电离方程式_____________________________。
Ⅱ.按要求回答下列问题:
(1)画 出 Cl-结构示意图 :____________。
(2)请用![]() 的形式,写出质子数为8,中子数为10的微粒符号_______。
的形式,写出质子数为8,中子数为10的微粒符号_______。
(3)某金属氯化物 MCl2 40.5g 中含有 0.6mol Cl-,则M的摩尔质量为____。
(4)相同温度和体积的 A 和 B 两容器,A容器中充满CO2,B容器中充满 O3,若密度相同,则二氧化碳和臭氧的物质的量之比为:_______。
(5)将24.5g H2SO4溶于水配成500mL溶液,其中SO42-的物质的量浓度为__________。
【答案】⑥ Cl2+H2O ![]() HCl+HClO NaHCO3=Na++HCO3-
HCl+HClO NaHCO3=Na++HCO3- 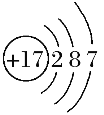
![]() O; 64g/mol 12:11 0.5mol/L
O; 64g/mol 12:11 0.5mol/L
【解析】
Ⅰ.(1)①Cl2、②钠是单质,⑦氨水、⑧稀硝酸是混合物,所以①②⑦⑧既不是电解质也不是非电解质; ④CO2是非电解质;③醋酸(CH3COOH)、⑤H2SO4、⑥熔融KNO3、⑨Al2(SO4)3固体、⑩NaHCO3是电解质,但能导电的只有⑥熔融KNO3,故答案为:⑥;
(2)Cl2与水反应生成盐酸和次氯酸,是可逆反应,方程式为 Cl2+H2O ![]() HCl+HClO ;
HCl+HClO ;
(3)碳酸氢钠为强电解质,全电离,但碳酸是弱酸,碳酸氢根离子不拆,电离方程式为NaHCO3=Na++HCO3- ;
Ⅱ.(1)氯为17号元素,氯离子最外层为8个电子,Cl-结构示意图 :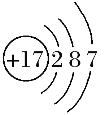 。
。
(2)质子数为8,中子数为10的微粒,质量数为18,符号为![]() O。
O。
(3)某金属氯化物 MCl240.5g中含有 0.6mol Cl-,则n(MCl2)=n(Cl-)/2=0.6mol×1/2=0.3mol,M(MCl2)=40.5g/0.3mol=135g·mol-1,则M的相对原子量为:135-35.5×2=64,M的摩尔质量为64g·mol-1;
(4)相同温度和体积的A和B两容器,A容器中充满CO2,B 容器中充满O3,若密度相同,根据m=ρV可知二氧化碳和臭氧的质量相等,则二氧化碳和臭氧的物质的量之比为m/44:m/48=12:11;
(5)24.5g H2SO4的物质的量为:n(H2SO4)=24.5g/98g·mol-1=0.25mol,H2SO4为强电解质,n(SO42-)=n(H2SO4)=0.25mol,则c(SO42-)=0.25mol/0.5L=0.5mol·L-1。

 口算能手系列答案
口算能手系列答案