题目内容
【题目】如图表示配制100mL0.100molL﹣1Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
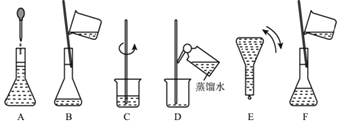
(1)用容量瓶配制一定物质的量浓度的溶液,该容量瓶必须是_____。
①干燥的 ②瓶塞不漏水的 ③用欲配制的溶液润洗过的 ④以上三项均须要求的
(2)若用Na2CO310H2O来配制溶液,需要称量晶体_____克。若所称取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏_____。(填“大/小”)
(3)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、_____。
(4)步骤B通常称为转移,步骤A通常称为_____。步骤D称为_____,若没有步骤D,则配制的浓度偏_____。(填“大/小”)。
(5)将上述实验步骤A﹣F按实验过程先后次序排列_____。
【答案】② 2.9 大 玻璃棒,胶头滴管、100 mL容量瓶 定容 洗涤 小 CBDFAE
【解析】
(1)根据容量瓶是准确配制一定物质的量浓度的溶液的仪器,结合溶液的均一性、稳定性分析;
(2)根据n=c·V计算溶质Na2CO3的物质的量,根据C元素守恒,根据Na2CO310H2O的物质的量等于Na2CO3的物质的量,根据m=n·M计算Na2CO310H2O的质量;根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(3)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(4)用胶头滴管滴加溶液的操作名称是定容;步骤D用蒸馏水洗涤玻璃棒的操作名称是洗涤;根据c=![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(5)根据配制溶液的实验操作过程进行实验步骤排序。
(1)①配制一定物质的量浓度的溶液,是将一定质量或体积的溶质按溶液的体积在选定的容量瓶中定容的,故容量瓶是否干燥对所配溶液无影响;②瓶塞不漏水的,使用前需检漏;③用所配的溶液润洗容量瓶会有一部分溶质沾到容量瓶内壁上,溶质多;④只需要②;
故合理选项是②;
(2)配制 100 mL 0.100 mol/L Na2CO3溶液需要Na2CO310H2O的物质的量为n(Na2CO3)=0.1L×0.100mol/L=0.010mol,则根据元素守恒可知需要Na2CO310H2O的物质的量n(Na2CO310H2O)= n(Na2CO3)=0.010mol,故其质量m(Na2CO310H2O)=0.010mol×286g/mol=2.86g。由于托盘天平只能称量到小数点后一位,所以需要Na2CO310H2O的质量为2.9g;若所称取的晶体已经有一部分失去了结晶水,则晶体中Na2CO3的质量分数增大,溶质质量偏高,导致配制的溶液浓度偏大;
(3)根据配制溶液的步骤:计算→称量→溶解→冷却→移液→洗涤→定容→摇匀→装瓶贴签可知,配制溶液中所需要用到的玻璃仪器有烧杯、玻璃棒,胶头滴管、100 mL容量瓶;
(4)根据图示可知操作A为定容,操作D为洗涤,若没有步骤D洗涤,则溶质损失,根据物质的量浓度定义式c=![]() 进行分析,可知溶质的物质的量偏少,则配制的浓度偏小;
进行分析,可知溶质的物质的量偏少,则配制的浓度偏小;
(5)由溶液配制的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以实验过程先后次序排列为:C、B、D、F、A、E。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
【题目】氮的化合物用途广泛。回答下列问题:
(1)在一定条件下,氮气能和水蒸气反应生成氨气和氧气2N2(g)+6H2O(g)=4NH3(g)+3O2(g)△H,与该反应相关的化学键键能数据如下:
化学键 | N≡N | H—O | N—H | O=O |
E(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ·mol-1。
(2)在恒容密闭容器中充入2 mol N2O5与1molO2发生反应4NO2 (g) + O2 (g) ![]() 2N2O5 (g) △H。
2N2O5 (g) △H。
①已知在不同温度下测得N2O5的物质的量随时间的变化如图所示,该反应的△H_____0(填“>”“<”或“=”)。高温下该反应能逆向自发进行,其原因是___________________。

②下列有关该反应的说法正确的是_______(填标号)。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2 mol NO2和1molO2,再次达到平衡时,NO2的转化率增大
C.恒温恒容,当容器内的密度保持不变时,反应达到了平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图所示。则硼氢化钠燃料电池的负极反应式为_________。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01molL—1的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________。
0.01molL—1的溶液 | X | Y | Z | W |
pH | 12 | 2 | 8.5 | 4.5 |
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s) ![]() NaNO3 (s)+ClNO(g) K1
NaNO3 (s)+ClNO(g) K1
Ⅱ:2NO(g)+Cl2 (g) ![]() 2CNO(g) K2
2CNO(g) K2
①4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=____(用K1、K2表示)。
②在恒温条件下,向2L恒容密闭容器中加入0.2 mol NO和0.1 mol Cl2,10min时反应Ⅱ达到平衡,测得10min内v(ClNO)=7.5×10-3molL-1min-1,则平衡时NO的转化率α1=____;若其他条件不变,反应Ⅱ在恒压条件下进行,平衡时NO的转化率α2__α1(填“>”“<”或“=”)。

