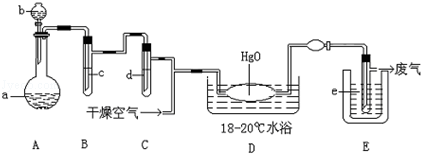
题目内容
碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用。甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答。
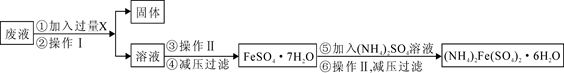
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:
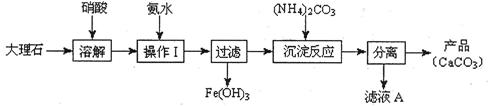
①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4 2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。
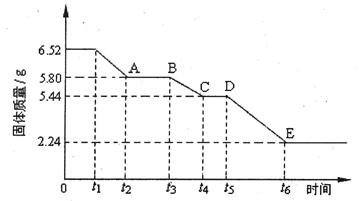
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如下:

①溶解大理石时,用硝酸而不用硫酸的原因是 。
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、 、 。
③“滤液A”中除H+离子外,还含有的阳离子是 ;检验该阳离子的实验方法是:取少量滤液A与 在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可。
(2)乙组对某硫酸钙晶体(xCaS04·yH20)加热分解的有关反应进行探究。他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如下图所示。又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4
 2CaO+2S02↑+O2↑。
2CaO+2S02↑+O2↑。
①加热时,该晶体开始发生化学变化的时间是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体的化学式为 。
③tl~t2时间段固体发生反应的化学方程式为 。
(1)①硫酸钙微溶于水(1分)
②洗涤(1分) 干燥(1分)
③NH4+(或铵根离子)(1分) 烧碱(溶液)(1分)
(2)①t1(1分)
②CaSO4(2分)
③2CaSO4·3H2O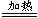 2CaSO4·H2O+2H2O(2分)
2CaSO4·H2O+2H2O(2分)
②洗涤(1分) 干燥(1分)
③NH4+(或铵根离子)(1分) 烧碱(溶液)(1分)
(2)①t1(1分)
②CaSO4(2分)
③2CaSO4·3H2O
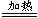 2CaSO4·H2O+2H2O(2分)
2CaSO4·H2O+2H2O(2分)试题分析:(1)①大理石与硫酸反应生成微溶的硫酸钙附着在大理石表面,阻碍反应的进行;②分离操作后得到产品碳酸钙,故先过滤得到沉淀,再经过洗涤、干燥等制的纯净的样品;③滤液A是碳酸铵和硝酸钙反应后的溶液,阳离子含有铵根离子;(2)晶体的质量开始变小,就开始化学变化,先失去结晶水,后硫酸钙分解。根据图示最后反应生成氧化钙,
n(CaO)=2.24÷56=0.04mol 样品中n(H2O)=(6.52-0.04×136)÷18=0.06mol
化学式为 2CaS04·3H20
AB端产物判断n(H2O)=(6.52-5.80)÷18=0.04mol,剩余水为0.03mol
产物化学式为2CaS04·H20
CD端产物的判断n(H2O)=(6.52-5.44)÷18=0.06mol,结晶水全部失去,产物化学式为CaS04
最后为氧化钙

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目