题目内容
【题目】几种物质的化学式及其名称分别是:Na2S2O3硫代硫酸钠;CaSx多硫化钙;BaO2过氧化钡。根据上述命名规律K2CS3的名称应为( )
A.三硫代碳酸钾 B.多硫碳化钙肥 C.过硫碳酸钾 D.超硫碳酸钾
【答案】A
【解析】
试题分析:Na2S2O3可看作硫酸钠(Na2SO4)中一个氧原子被一个硫原子代替,故称硫代硫酸钠.CaSx可看作硫化钙(CaS)中硫原子数目增加,故称多硫化钙.BaO2可看作氧化钡(BaO)中增加一个氧原子,故称过氧化钡.而K2CS3的可看作是K2CO3中三个氧原子被三个硫原子代替,和Na2S2O3命名原理一样.故选A

【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
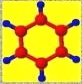
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:__________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为____________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
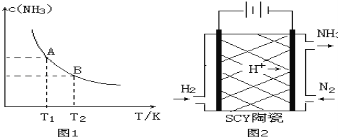
当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”)。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
若N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)