题目内容
【题目】(1)下图是等质量的碳酸钠、碳酸氢钠粉末分别与足量的盐酸发生反应时的情景,产生二氧化碳气体的体积较多的试管中加入的固体试剂是________,当反应结束时,A、B中消耗的盐酸的质量之比为________。

(2)实验过程中我们还能感受到碳酸钠与盐酸反应时是放热反应,而碳酸氢钠与盐酸反应时表现为吸热。在A、B试管的反应过程中,反应体系的能量变化的总趋势分别对应于A为________,B为________(填“a”或“b”)。
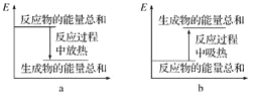
【答案】碳酸氢钠(NaHCO3);53 :84;(b)(a)
【解析】
试题由于碳酸钠的摩尔质量大于碳酸氢钠的,所以在质量相等的条件下,碳酸氢钠和盐酸反应放出的二氧化碳气态多,所以A试管中加入的是碳酸氢钠,B中加入的是碳酸钠。反应的化学方程式是Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+H2O+CO2↑,所以在质量相等的条件下,A、B两试管中消耗盐酸的质量之比是![]() ︰
︰![]() =53 :84;反应放热,说明反应物的总能量高于生成物的总能量。反应吸热,说明反应物的总能量低于生成物的总能量,因此A试管对应b,B试管对应a。
=53 :84;反应放热,说明反应物的总能量高于生成物的总能量。反应吸热,说明反应物的总能量低于生成物的总能量,因此A试管对应b,B试管对应a。

【题目】下表是元素周期表短周期的一部分:
① | ||||||||
⑨ | ② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1) ①-⑦元素中非金属性最强的元素位于周期表中的位置为______________________。
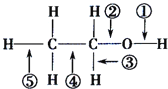
(2) ③与⑤形成的化合物与水反应产生气体,该反应的化学方程式 _______________ 。该化合物的电子式为______
(3) ④所形成的单质与水反应的方程式 _____________。
(4) ②、③、⑨的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示)。
(5) 表中元素⑤和⑥的最高价氧化物的水化物之间相互反应的离子方程式为____________。
(6) ②的气态氢化物的实验室制法的反应原理:____________________;(写出化学方程式)
②的气态氢化物和它的最高价氧化物的水化物反应的产物为______________(“离子”或“共价”)化合物。
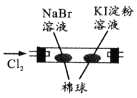
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
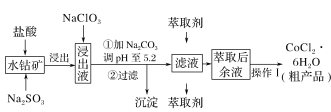
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86 ℃,加热至110~120 ℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程Co2O3发生反应的离子方程式:______________。
(2)写出NaClO3发生反应的主要离子方程式:_____________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为________。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、_________和过滤。
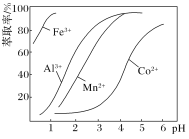
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是____________;萃取剂使用的最佳pH范围是_____(填代号)。
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.51
(6)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________________。(答一条即可)