题目内容
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
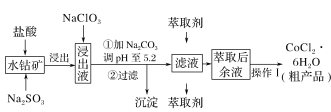
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86 ℃,加热至110~120 ℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程Co2O3发生反应的离子方程式:______________。
(2)写出NaClO3发生反应的主要离子方程式:_____________;
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为________。
(4)“操作1”中包含3个基本实验操作,它们依次是_________、_________和过滤。
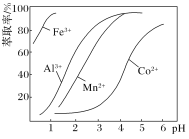
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是____________;萃取剂使用的最佳pH范围是_____(填代号)。
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.51
(6)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________________。(答一条即可)
【答案】Co2O3+SO32-+4H+===2Co2++SO42-+2H2OClO3-+6Fe2++6H+===Cl-+6Fe3++3H2OFe(OH)3、Al(OH)3蒸发浓缩冷却结晶除去“滤液”中的Mn2+B粗产品中含有可溶性氯化物或晶体失去了部分结晶水
【解析】
含钴废料中加入盐酸,可得浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,加入NaClO3,将Fe2+氧化成Fe3+,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2·6H2O晶体,进行蒸发浓缩、冷却结晶和过滤的操作,以此分析解答。
(1)根据已知信息,浸出液含有Co2+,而Co2O3中Co化合价为+3,与亚硫酸根离子发生氧化还原反应,离子方程式为:Co2O3+SO32-+4H+===2Co2++SO42-+2H2O,
因此,本题正确答案是:Co2O3+SO32-+4H+===2Co2++SO42-+2H2O;
(2)从表中数据看,亚铁离子沉淀完全时,Co2+已经沉淀完全,无法得到产品,因此需要将亚铁离子氧化为铁离子,NaClO3的作用就是将Fe2+氧化成Fe3+,该反应的离子方程式为ClO3-+6Fe2++6H+===Cl-+6Fe3++3H2O,
因此,本题正确答案是:ClO3-+6Fe2++6H+===Cl-+6Fe3++3H2O;
(3)从表中数据看加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3,
因此,本题正确答案是:Fe(OH)3、Al(OH)3 ;
(4)萃取后的余液主要是CoCl2,欲获得晶体CoCl2·6H2O,从溶液中制取结晶水合物的操作步骤是蒸发浓缩、冷却结晶和过滤,则操作1为蒸发浓缩、冷却结晶、过滤,
因此,本题正确答案是:蒸发浓缩;冷却结晶;
(5)Mn2+生成氢氧化物沉淀完全时Co2+已经沉淀完全,需要除去Mn2+,萃取剂的作用是除去溶液中的Mn2+;从图中看pH为3~3.5时锰离子萃取率可以达到80%以上,而Co2+萃取率仅10%左右,故选B。
因此,本题正确答案是:除去“滤液”中的Mn2+ ;B;
(6)粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是粗产品中混有Cl-含量比样品高的可溶性氯化物或晶体失去了部分结晶水等,
因此,本题正确答案是:粗产品中含有可溶性氯化物或晶体失去了部分结晶水。