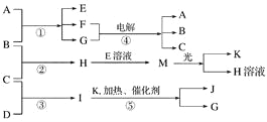
题目内容
【题目】下表是元素周期表短周期的一部分:
① | ||||||||
⑨ | ② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1) ①-⑦元素中非金属性最强的元素位于周期表中的位置为______________________。
(2) ③与⑤形成的化合物与水反应产生气体,该反应的化学方程式 _______________ 。该化合物的电子式为______
(3) ④所形成的单质与水反应的方程式 _____________。
(4) ②、③、⑨的最高价含氧酸的酸性由弱到强的顺序是__________________(用化学式表示)。
(5) 表中元素⑤和⑥的最高价氧化物的水化物之间相互反应的离子方程式为____________。
(6) ②的气态氢化物的实验室制法的反应原理:____________________;(写出化学方程式)
②的气态氢化物和它的最高价氧化物的水化物反应的产物为______________(“离子”或“共价”)化合物。
【答案】第二周期VIIA族 略 略 2F2+2H2O=4HF+O2↑ H2SiO3< H2CO3< HNO3 Al(OH)3+OH-== AlO2- + 2H2O 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 离子
CaCl2+2NH3↑+2H2O 离子
【解析】
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S,则
(1)同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
(2)③与⑤形成的化合物为Na3N,依据氮化钠是离子化合物,三个钠原子失去三个电子,给N原子,使N原子最外层达到稳定结构,电子式需要标注离子所带电荷数;
(3)④所形成的单质为氟气,与水反应是生成HF与氧气;
(4)非金属性越强,对应元素最高价含氧酸的酸性越强;
(5)表中元素⑤和⑥对应最高价氧化物的水化物分别为NaOH与Al(OH)3;
(6)②的气态氢化物为氨气,实验室用氯化铵与氢氧化钙在加热条件下制得,铵盐属于离子化合物。
由元素在周期表中位置,可知①为H、②为C、③为N、④为F、⑤为Mg、⑥为Al、⑦为Si、⑧为S,则
(1)①-⑦元素中非金属性最强的元素为F,原子序数为9,则在元素周期表的位置为;第二周期VIIA族,
故答案为:第二周期VIIA族;
(2)③与⑤形成的化合物为Na3N,Na3N中Na是+1价,N是-3价,方程式是Na3N+3H2O=3NaOH+NH3↑,其电子式为:![]() ,
,
故答案为:Na3N;![]() ;
;
(3)④所形成的单质为氟气,与水反应是生成HF与氧气,其反应方程式为:2F2+2H2O=4HF+O2↑,
故答案为:2F2+2H2O=4HF+O2↑;
(4)②、③、⑨的最高价含氧酸分别为H2CO3、HNO3、H2SiO3,因非金属性强弱顺序为: Si< C< N,则②、③、⑨的最高价含氧酸的酸性由弱到强的顺序是;H2SiO3< H2CO3< HNO3,
故答案为:H2SiO3< H2CO3< HNO3;
(5)表中元素⑤和⑥的最高价氧化物的水化物分别为NaOH与Al(OH)3,两者反应生成偏铝酸钠与水,其对应的离子方程式为:Al(OH)3+OH-== AlO2- + 2H2O,
故答案为:Al(OH)3+OH-== AlO2- + 2H2O;
(6)②的气态氢化物为氨气,实验室用氯化铵与氢氧化钙在加热条件下制得,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;②的气态氢化物氨气和它的最高价氧化物的水化物硝酸发生反应生成硝酸铵,该化合物属于离子化合物,
CaCl2+2NH3↑+2H2O;②的气态氢化物氨气和它的最高价氧化物的水化物硝酸发生反应生成硝酸铵,该化合物属于离子化合物,
故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;离子;
CaCl2+2NH3↑+2H2O;离子;

 期末集结号系列答案
期末集结号系列答案【题目】如表为周期表中短周期的一部分,若X原子的最外层电子数是Y原子内层电子总数的![]() ,则下列说法不正确的是
,则下列说法不正确的是![]()
![]()
W |
|
|
|
| X | Y | Z |
A. Y的最高价氧化物的水化物的酸性比X的强 B. W、Z组成的某化合物是一种常见的溶剂
C. 原子半径大小比较:![]() D. W形成的氢化物种类很多
D. W形成的氢化物种类很多