题目内容
14.下列说法中,正确的是( )| A. | Na2O、Na2O2为相同元素组成的金属氧化物,都属于碱性氧化物 | |
| B. | SiO2、CO2均为酸性氧化物,均能与NaOH溶液反应生成盐和水 | |
| C. | FeO、Fe2O3均为碱性氧化物,与氢碘酸反应均只发生复分解反应 | |
| D. | 将Fe(OH)3胶体和泥水分别进行过滤,分散质均不能通过滤纸孔隙 |
分析 A、碱性氧化物是指能和酸反应生成盐和水的化合物,根据氧化钠过氧化钠的性质来回答;
B、酸性氧化物是指能和碱反应生成盐和水的氧化物;
C、三价铁离子具有氧化性,能和还原性的碘离子之间发生反应;
D、胶体和溶液中的分散质微粒能通过滤纸.
解答 解:A、Na2O、Na2O2为相同元素组成的金属氧化物,氧化钠属于碱性氧化物,但是过氧化钠不属于碱性氧化物,故A错误;
B、SiO2、CO2均均能与NaOH溶液反应生成盐和水,为酸性氧化物,故B正确;
C、FeO、Fe2O3均为碱性氧化物,氧化铁与氢碘酸反应可以得到铁离子,具有氧化性,能被还原性的碘离子还原,其中还会发生氧化还原反应,故C错误;
D、将Fe(OH)3胶体和泥水分别进行过滤,分散质均能通过滤纸孔隙,故D错误.
故选B.
点评 本题涉及物质的分来以及物质的性质等方面知识的考查,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
4.CO2和CO可以回收利用制取二甲醚、尿素、甲醇等.
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol.
(2)CO2合成尿素的反应为:CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)△H<0.该反应的平衡常数表达式为$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$.
(3)实验室模拟用CO和H2反应来制甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
①x=0.14.
②250℃时该反应的平衡常数K值为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2(不必化简).
③若6min~8min只改变了某一条件,所改变的条件是加入1mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol.
(2)CO2合成尿素的反应为:CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)△H<0.该反应的平衡常数表达式为$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$.
(3)实验室模拟用CO和H2反应来制甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K值为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2(不必化简).
③若6min~8min只改变了某一条件,所改变的条件是加入1mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
19.下列过程中,没有明显实验现象的是( )
| A. | 加热溶有SO2的品红溶液 | |
| B. | 将HCl通入NaAlO2溶液中 | |
| C. | 向Fe(NO3)2溶液中滴加稀硫酸 | |
| D. | 向碳酸氢钠溶液中滴加氢氧化钠溶液 |
6.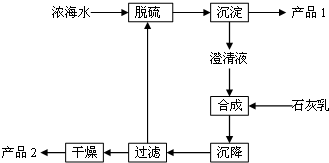 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是 .
.
②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
①脱硫阶段主要反应的离子方程式为Ca2++SO42-═CaSO4↓;
②产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
 将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.
将海水淡化后,从剩余的浓海水中通过一系列工艺流程可以生产其他产品.(1)Cl2可以氧化浓海水中的Br-,用空气吹出Br2,并用纯碱吸收.纯碱吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(化学方程式未配平),则吸收1mol Br2时,该反应转移的电子为$\frac{5}{3}$mol.
(2)精制浓海水可以得到纯净的饱和食盐水,向其中加入碳酸氢铵可制备碳酸氢钠.
①NaCl的电子式是
 .
.②上述制备碳酸氢钠的化学方程式是NaCl+NH4HCO3═NaHCO3↓+NH4Cl.
③为测定制得的碳酸氢钠的纯度,可称量a g碳酸氢钠样品(含少量NaCl)溶于足量盐酸,蒸干溶液后灼烧,剩余固体质量为b g.样品碳酸氢钠的质量分数是$\frac{84(a-b)}{25.5a}$×100%(用含a、b的代数式表示).
(3)海水提取镁的一段工艺流程如图:
浓海水中的有关成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②产品2的化学式为Mg(OH)2;1L浓海水最多可得到产品2的质量为69.6 g.
3.下列离子在溶液中可以大量共存的一组是( )
| A. | H+ Na+ CO32- | B. | Na+ OH- Cl- | ||
| C. | K+ H+ CH3COO- | D. | Ba2+ SO42- NO3- |


 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.