题目内容
10.用15.8g KMnO4氧化密度为1.19g/cm3,溶质质量分数为36.5%的盐酸.反应方程式如下:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O(1)该盐酸的物质的量浓度为多少?
(2)有多少摩尔HCl被氧化?
(3)产生的Cl2在标准状况下的体积为多少?
分析 (1)根据c=$\frac{1000ρω}{M}$计算盐酸的物质的量浓度;
(2)根据n=$\frac{m}{M}$计算KMnO4的物质的量,根据方程式计算生成氯气物质的量,被氧化的HCl生成氯气,根据氯原子是计算被氧化HCl物质的量;
(3)根据V=nVm计算生成氯气的体积.
解答 解:(1)由c=$\frac{1000ρω}{M}$可知,密度为1.19g/cm3,溶质质量分数为36.5%的盐酸的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
答:该盐酸的物质的量浓度为11.9mol/L;
(2)15.8g KMnO4的物质的量为$\frac{15.8g}{158g/mol}$=0.1mol,根据2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
,可知n(Cl2)=$\frac{5}{2}$n(KMnO4)=0.1mol×$\frac{5}{2}$=0.25mol,被氧化的HCl生成氯气,根据氯原子可知,被氧化HCl物质的量为0.25mol×2=0.5mol,
答:被氧化的HCl为0.5mol;
(3)标况下生成氯气的体积为0.25mol×22.4L/mol=5.6L,
答:Cl2在标准状况下的体积为5.6L.
点评 本题考查物质的量浓度计算、化学方程式计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列说法正确的是( )
| A. | 金属元素不能得电子,不显负价,故金属元素不能形成阴离子 | |
| B. | P,S,Cl元素最高价依次升高 | |
| C. | B,C,N,O,F原子半径依次增大 | |
| D. | Li,Na,K,Rb的氧化物对应水化物的碱性依次减弱 |
18.已知反应A(g)+3B(g)?2C(g)+2D(g),下列反应速率最大的是( )
| A. | v(D)=0.4 mol•L-1•s-1 | B. | v (C)=0.5 mol•L-1•s-1 | ||
| C. | v (B)=0.6 mol•L-1•s-1 | D. | v (A)=0.15 mol•L-1•s-1 |
5.下列反应中,属于吸热反应的是( )
| A. | 甲烷在氧气中燃烧 | |
| B. | 稀硫酸和氢氧化钠溶液发生中和反应 | |
| C. | 金属钠和水反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 |
15.与水混合时均出现分层,且有机层均在上层的一组物质是( )
| A. | 苯、甲苯 | B. | 硝基苯、己烷 | C. | 溴乙烷、乙酸乙酯 | D. | 氯仿、酒精 |
2.在一定温度下的恒容容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | C. | B的物质的量浓度 | D. | 物质A的质量 |
19.下列说法正确的是( )
| A. | 1molH2的体积为22.4L | |
| B. | Na+的摩尔质量是23 g/mol | |
| C. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| D. | 标准状况下,将22.4LHCl溶于1L水中,其物质的量浓度为1mol/L |
20.随着能源危机影响的加剧,全球寻找新能源的步伐加快,下列几种能源中不属于新能源的是( )
| A. | 石 油 | B. | 风 能 | C. | 太阳能 | D. | 潮汐能 |
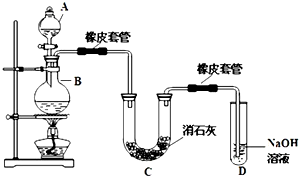 瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成份是MnO2 )的过程中,将它与浓盐酸混合物加热,产生了一种黄绿色、刺激性提心气味的气体----氯气.某学生使用这一原理设计如下图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: