题目内容
7.用足量CO还原14.4g某铁的氧化物,将生成的CO2全部通入470ml0.5mol/L的石灰水中得到20g白色沉淀,通过计算求出铁的氧化物的化学式.分析 20g沉淀为碳酸钙,根据n=$\frac{m}{M}$计算碳酸钙物质的量,进而计算二氧化碳的物质的量,CO获得氧化物中O原子转化为CO2,据此计算氧化物中氧原子物质的量,进而计算Fe原子物质的量,根据Fe、O原子数目之比判断.
解答 解:a讨论:当二氧化碳与石灰水反应,二氧化碳少量时则CO2+Ca(OH)2=CaCO3↓+H2O
根据C原子守恒,那么n(C)=0.2mol
设Fe的氧化物为FexOy
FexOy+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2
∴n(FexOy):n(CO)=1:y
∴$\frac{14.4g}{(56x+16y)g/mol}$:0.2mol=1:y
解之得:$\frac{x}{y}=\frac{1}{1}$
∴铁的氧化物为FeO
b当CO2与Ca(OH)2反应CO2过量时
则还应考虑CaCO3+H2O+CO2=Ca(HCO3)2
根据m(CaCO3)的质量可求出与Ca(OH)2反应的CO2
n(CO2)=0.27mol
同理:可求出铁的氧化物为Fe2O3,答:铁的氧化物的化学式为:FeO或Fe2O3.
点评 本题考查混合物反应有关计算,根据守恒法计算Fe、O原子数目之比,侧重考查学生分析计算能力,难度不大.

练习册系列答案
相关题目
17.在一定条件下,下列可逆反应达到化学平衡:H2(g)+I2(g)(紫黑色)?2HI(g)△H<0,要使混合气体的紫黑色加深:采取的方法是( )
| A. | 降低温度 | B. | 升高温度 | C. | 减小体积 | D. | 增大体积 |
18.湖南省常德市石门县鹤山村用土法炼砒霜导致地下水砷污染严重,157人中毒死亡.关于砷(33As)的说法不正确的是( )
| A. | 砷的氢化物和磷的氢化物的稳定性为PH3<AsH3 | |
| B. | 砷原子核内有33个质子 | |
| C. | 砷是第四周期第VA族 | |
| D. | 砷的最高价氧化物对应的水化物的化学式是H3AsO4 |
15.0.1mol某有机物的蒸气跟足量的O2混合后点燃,反应后生成13.2g CO2和5.4g H2O,该有机物能跟Na反应放出H2,又能跟新制Cu(OH)2反应生成红色沉淀,此有机物还可与乙酸反应生成酯类化合物,该酯类化合物的结构简式可能是( )
| A. | OHC-CH2-CH2COOCH3 | |
| B. |  | |
| C. | 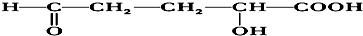 | |
| D. |  |
19.下列有关主族元素M、N非金属性强弱比较的说明中,正确的是( )
| 事实 | 非金属 | |
| A | 第I电离能 M<N | M>N |
| B | 电负性M=N | M=N |
| C | 基态原子价层电子排布 M:nsnnpn+3,N:nsnnpn+4 | M>n |
| D | 原子半径 M>N | M<N |
| A. | A | B. | B | C. | C | D. | D |
7.“粉骨碎身浑不怕,要留清白在人间”赞颂的是石灰石(碳酸钙),碳酸钙属于( )
| A. | 单质 | B. | 氧化物 | C. | 酸 | D. | 盐 |


 或
或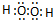 .
.