题目内容
16.(1)原子核内无中子的元素可放在元素周期表的ⅠA族,又根据最高正化合价和负化合价的绝对值相等可放在ⅣA族,该元素还可放在元素周期表的ⅤⅡA族.它的核外电子排布式为1s1,它和氧元素可形成的化合物的电子式为 或
或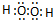 .
.(2)科学家发现在特殊条件下,水能表现出许多有趣的结构和性质. 一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”.则A、B两幅图中能表示“热冰”的示意图为A.使水结成“热冰”采用“弱电场”的条件,说明水分子是极性分子.(选填“极性”或“非极性”)

(3)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子(H2O+).这种阳离子具有较强的氧化性,试写出该离子与H2S的水溶液反应的离子方程式2H2O++H2S=S↓+2H2O+2H+;该反应破坏的化学键是极性共价键.
分析 (1)原子核内无中子的元素是氢,氢是第一周期第ⅠA元素,元素最高正价与负化合价的绝对值相等,所以最外层有4个电子,还可以是氢最高正价是+1价,最低负价是负1价,所以可以将氢放在ⅤⅡA,核外电子排布为1s1,氢与氧形成水和过氧化氢;
(2)水是极性分子极性分子能在电场作用下凝结;
(3)H2O+具有较强的氧化性,能与硫化氢发生氧化还原反应,反应方程式为:2H2O++H2S=S↓+2H2O+2H+,反应过程中破坏了硫化氢分子和H2O+中的极性共价键.
解答 解:(1)原子核内无中子的元素是氢,氢是第一周期第ⅠA元素,元素最高正价与负化合价的绝对值相等,所以最外层有4个电子,所以是ⅣA,还可以是氢最高正价是+1价,最低负价是负1价,所以可以将氢放在ⅤⅡA,核外电子排布为1s1,氢与氧形成水和过氧化氢,水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,双氧水的电子式为:
,双氧水的电子式为: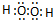 ,
,
故答案为:ⅠA;ⅣA;ⅤⅡA;1s1; 或
或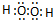 ;
;
(2)水是极性分子,所以在电场作用下的凝结,所以热冰是A,水是极性分子,故答案为:A;极性;
(3)H2O+具有较强的氧化性,能与硫化氢发生氧化还原反应,反应方程式为:2H2O++H2S=S↓+2H2O+2H+,反应过程中破坏了硫化氢分子和H2O+中的极性共价键,故答案为:2H2O++H2S=S↓+2H2O+2H+;极性共价键.
点评 本题为信息给予题目,为高考常见题型和高频考点,侧重于学生的分析能力和自学能力的考查,注意把握题给信息并结合物质的性质为解答该题的关键,题目难度中等,题中易错点为(2),注意离子方程式的书写方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列事实不能用勒沙特列原理解释的是( )
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 500℃左右比常况下更有利于合成氨 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率 |
1.煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是abc(填字母,下同).
a.容器中的压强不变
b.1molH-H 键断裂的同时断裂 2molH-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的 CO(g)和 H2O(g)分别通入到体积为 2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
实验中以 v(CO2)表示的反应速率为0.16mol/(L•min)达平衡时 CO 的体积分数为40%
(3)目前工业上有一种方法是用 CO2来生产甲醇.一定条件下,在体积为 1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g).一定温度下,在一个容积不变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是abc(填字母,下同).
a.容器中的压强不变
b.1molH-H 键断裂的同时断裂 2molH-O 键
c.混合气体密度不变
d.c(CO)=c(H2)
(2)将不同量的 CO(g)和 H2O(g)分别通入到体积为 2L 的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到数据如下:
| 起始量/mol | 平衡量/mo l | 达到平衡所 | ||||||
| 需时间/min | ||||||||
| H2O | CO | H2 | CO | |||||
| 2 | 4 | 1.6 | 2.4 | 5 | ||||
(3)目前工业上有一种方法是用 CO2来生产甲醇.一定条件下,在体积为 1L 的恒容密闭容器中,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).为了加快反应速率,可采取什么措施(写两条)升温、使用催化剂.
15.100mL 0.3mol•L-1 HCl溶液加水稀释到500mL,则得到的溶液中H+离子的物质的量浓度为( )
| A. | 0.01mol•L-1 | B. | 0.02mol•L-1 | C. | 0.03mol•L-1 | D. | 0.06mol•L-1 |
16.用锌片与稀硫酸反应制取氢气时.下列措施使氢气生成速率变化最小的是( )
| A. | 加人少量硫酸铜晶体 | B. | 不用稀硫酸而用浓硫酸 | ||
| C. | 用锌粉代替锌片 | D. | 加少量BaCl2晶体 |
 +2H2O.
+2H2O.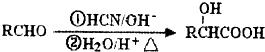
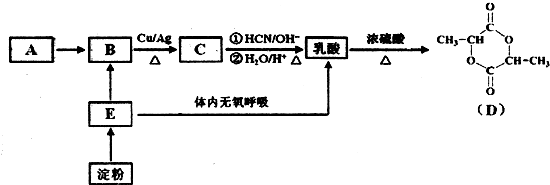
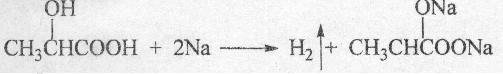 .
. .
.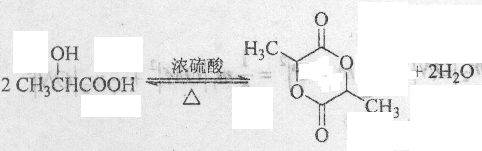 .
. .
.