题目内容
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

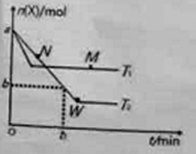
(1)100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol·L-1·s-1。
(2)100℃时达到平衡后,改变反应温度为T,N2O4以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。则T___100℃(填“大于”或“小于”)。
(3)计算温度T时反应的平衡常数K2___(写出必要的计算过程)。
【答案】0.0010molL-1s-1 大于 1.3mol/L
【解析】
(1)根据反应速率v=![]() 计算;
计算;
(2)N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
(3)计算T℃时两种物质的浓度,计算得到化学平衡常数。
(1)0~60s时段,N2O4浓度变化为:0.100mol/L-0.040mol/L=0.060mol/L,v(N2O4)=![]() =0.0010molL-1s-1;
=0.0010molL-1s-1;
(2)N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;
(3)平衡时,c(NO2)=0.120molL-1+0.0020molL-1s-1×10s×2=0.16molL-1,c(N2O4)=0.040molL-1-0.0020molL-1s-1×10s=0.020molL-1,K2=![]() =1.3mol/L。
=1.3mol/L。

【题目】下列物质的用途是利用其物理性质的是
选项 | 物质 | 用途 |
A | 四氢噻吩( | 作为杂质气体添加到家用天然气中,警示气体泄漏 |
B | 铁粉 | 装入透气纸袋中,用于富脂食品包装袋中 |
C | KMnO4 | 浸泡硅藻土,用作新鲜水果的保鲜剂 |
D | K2Cr2O7 | 用于酒驾检测仪中,检验司机是否酒驾 |
A.AB.BC.CD.D
【题目】根据下列化学实验示意图及表中实验现象,从理论上分析得出的结论正确的是

选项 | 实验 | 实验现象 | 结论 |
A | a | 左烧杯中铁表面有气泡,右烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | b | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | c | 白色固体先变为淡黄色,后变为黑色 | 溶解度:AgCl < AgBr < Ag2S |
D | d | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A. A B. B C. C D. D