题目内容
【题目】在2L密闭容器中通入amolX气体并发生反应:2X(g)![]() Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示。下列叙述不正确的是( )
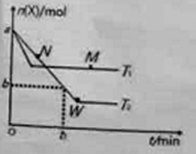
A.正反应方向为放热反应
B.在T2温度下,在0~t1时间内,v(Y)=![]()
C.M点的正反应速率v(正)大于N点的逆反应速率v(逆)
D.W点时再加入一定量X,平衡后X的转化率增大
【答案】B
【解析】
试题分析:A、T1先拐,先达到平衡,说明T1>T2,随着温度升高,X的物质的量增大,说明平衡向逆反应方向移动,根据勒夏特列原理,正反应方向为放热反应,故说法正确;B、根据化学反应速率的定义,v(X)=(a-b)/(t1×2)mol/(L·min),根据化学反应速率之比等于化学计量数之比,则v(Y)= (a-b)/(t1×4)mol/(L·min),故说法错误;C、T1的温度高于T2,温度高反应速率快,M点的正反应速率大于N点逆反应速率,故说法正确;D、W点达到化学平衡,再加入一定量X,相当于在原来基础上加压,平衡右移,X的转化率增大,故说法正确。

练习册系列答案
相关题目