题目内容
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
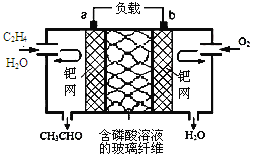
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
【答案】B
【解析】
A、根据题给信息知乙烯发生氧化反应,在燃料电池的负极反应,故a电极发生氧化反应,A错误;
B、放电时,负极发生CH2=CH2-2e-+ H2O=CH3CHO+2H+,每转移2mol电子,理论上需要消耗1mol乙烯,即28g,B正确;
C、b极反应式为:O2+4e-+4H+=2H2O,C错误;
D、原电池中电子只能通过导线和电极传递,不能通过溶液传递,D错误;
故合理选项为B。

练习册系列答案
相关题目