题目内容
【题目】改变0.1molL—1二元弱酸H2A溶液的pH,溶液中的H2A、HA—、A2—的物质的量分数δ(x)随pH的变化如图所示[已知δ(x)=c(x)/[c(H2A)+c(HA—)+c(A2—)]。下列叙述错误的是
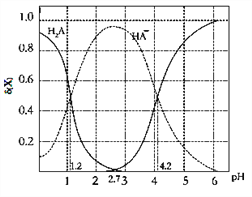
A. 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大
B. K2(H2A)=10﹣4.2
C. pH=2.7时,[c(HA—)]2/[c(H2A)c(A2—)]=100
D. pH=4.2时,c(HA﹣) =c (A2—)且c(H2A)≈0
【答案】C
【解析】A.向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离程度一直增大,选项A正确;B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2(H2A)=![]() =10-4.2,选项B正确;C.由图象可知,pH=1.2时,c(H2A)=c(HA-),Ka1= c(H+)=10-1.2,pH=2.7时,c(H2A)=c(A2-),[c(HA—)]2/[c(H2A)c(A2—)]= [c(HA—)]2/[c(H2A)]2=
=10-4.2,选项B正确;C.由图象可知,pH=1.2时,c(H2A)=c(HA-),Ka1= c(H+)=10-1.2,pH=2.7时,c(H2A)=c(A2-),[c(HA—)]2/[c(H2A)c(A2—)]= [c(HA—)]2/[c(H2A)]2=![]() =
=![]() =10-23.6,选项C错误;D.pH=4.2时,c(HA-)=c(A2-),此时c(H2A)≈0,选项D正确。答案选C。
=10-23.6,选项C错误;D.pH=4.2时,c(HA-)=c(A2-),此时c(H2A)≈0,选项D正确。答案选C。

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目