题目内容
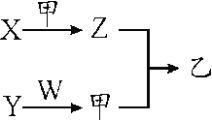
【题目】已知A、D为常见单质,各物质发生如下框图所示变化,回答下列问题:
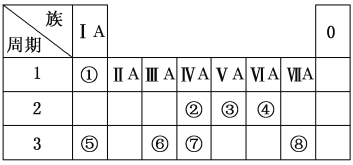
(1)若A、D为短周期同主族非金属元素的单质,则A元素在周期表中的位置为______,D的晶体类型是______,请写出A+B→C+D的化学方程式______。
(2)若B为气体,其标准状况下密度为1.964gL-1,C为白色固体,可用来制作耐高温材料。则B的电子式为______,C中含有的化学键是______(填写“离子键或者共价键”)。
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,写出C(金属元素有两种不同化合价)与盐酸反应的离子反应方程式____________。若以A和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,请写出石墨电极的电极反应式______。
【答案】第二周期第IVA族 原子晶体 SiO2+2C![]() Si+2CO
Si+2CO ![]() 离子键 Fe3O4+8H+=Fe2++2Fe3++4H2O O2+2H2O+4e-=4OH-
离子键 Fe3O4+8H+=Fe2++2Fe3++4H2O O2+2H2O+4e-=4OH-
【解析】
(1)若A、D为短周期同主族非金属元素的单质,由转化可知B、C属于氧化物,A与B的反应属于置换反应,可推知A为碳、B为SiO2、C为CO、D为Si,则A元素在周期表中的位置为:第二周期第IVA族,硅的晶体类型是原子晶体,A+B→C+D的化学方程式:SiO2+2C![]() Si+2CO;
Si+2CO;
(2)若B为气体,其标准状况下密度为1.964gL-1,B的相对分子质量=22.4×1.964=44,C为白色固体,可用来制作耐高温材料,则A为Mg、B为CO2、C为MgO、D为碳,B的电子式为![]() ,C(MgO)中含有的化学键是:离子键;
,C(MgO)中含有的化学键是:离子键;
(3)若A为生产生活中用量最大的金属,B在常温下为无色液体,则A为Fe、B为H2O、C为Fe3O4、D为H2,C与盐酸反应的离子反应方程式:Fe3O4+8H+=Fe2++2Fe3++4H2O,若以Fe和石墨棒为电极,NaCl溶液为电解质溶液构成原电池,石墨电极为正极,发生还原反应,氧气获得电子市场氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-。

 考前必练系列答案
考前必练系列答案