题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
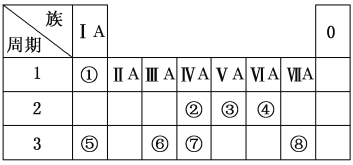
(1)②、④元素的原子按1∶2组成化合物的电子式:(用元素符号表示)_________________。
(2)⑤、⑧元素的化合物的用电子式表示形成过程:___________________________。
(3)①、⑤、⑥阳离子氧化性由弱到强的顺序是(用离子符号表示)_____________。
(4)①、④、⑤中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:________________。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
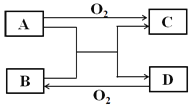
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
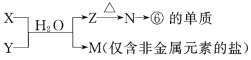
X溶液与Y溶液反应的离子方程式为___________________________________
【答案】![]()
![]() Na+、Al3+、H+
Na+、Al3+、H+ ![]() ab Al3++3NH3·H2O=Al(OH)3↓+3NH4+
ab Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
由元素在周期表中的位置确定元素,进而由元素单质及其化合物的性质回答问题。
(1)元素②、④按原子数1∶2组成化合物是CO2,它是原子间通过共用电子对形成的共价化合物,电子式是![]() 。
。
(2)元素⑤、⑧形成的化合物是NaCl,用电子式表示其形成过程为![]() 。
。
(3)通常,单质的还原性强,则对应离子的氧化性弱。①、⑤、⑥阳离子分别为H+、Na+、Al3+,氧化性由弱到强的顺序是Na+、Al3+、H+。
(4)要有离子键须有阴阳离子,要有极性共价键须不同种元素的原子间形成共用电子对。①、④、⑤形成NaOH符合,电子式是![]() 。
。
(5)由表中两种元素的原子按1∶1组成的常见液态化合物有苯(C6H6)、双氧水(H2O2)等,稀溶液易被催化分解的是H2O2,可使用的催化剂有ab。H2O2与Na2SO3或KMnO4发生氧化还原反应,分别作氧化剂、还原剂。
(6)⑥的单质为Al,据图中转化关系N为Al2O3、Al(OH)3。仅含非金属元素的盐通常为铵盐,结合表中元素,知M为NH4Cl。故X溶液与Y溶液反应的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。