��Ŀ����
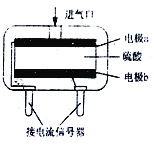
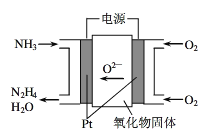
����Ŀ����1����ҵ������N2��H2�ϳ�NH3��NH3�ֿ��Խ�һ���Ʊ�������N2H4���ȡ���NH3�Ʊ�N2H4�ij��÷�����NaClO����������ѧ��̽���õ�ⷨ�Ʊ���Ч�ʣ�װ����ͼ����д���������缫��Ӧʽ__________________��
��2��ij��Ǧ�����ؾ������ۡ������������������ص㣬��ʹ�õĵ�����ǿ����Եļ�����Ǧ����صĹ���ԭ����Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
�ŵ�ʱ�������ĵ缫��ӦʽΪ_________�����ʱ��Pb�缫Ӧ����������ӵ緹��___�������������������
��3���Ҵ������DZ��㷺ʹ�õ��������ȼ�ϣ���ҵ�����Ҵ���CH3CH2OH����һ�ַ�Ӧԭ��Ϊ��2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ��H=-256.1kJ/mol
CH3CH2OH(g)+H2O(g) ��H=-256.1kJ/mol
��֪��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41.2kJ/mol
CO2(g)+H2(g) ��H=-41.2kJ/mol
��CO2(g)��H2(g)Ϊԭ��Ҳ�ɺϳ��Ҵ������Ȼ�ѧ����ʽΪ��___________��
��4������ˮ�е�NO3-��Ҫ����NH4+����֪���������õ������£�NH4+����������Ӧ��������NO3-��������Ӧ�������仯ʾ��ͼ���£�
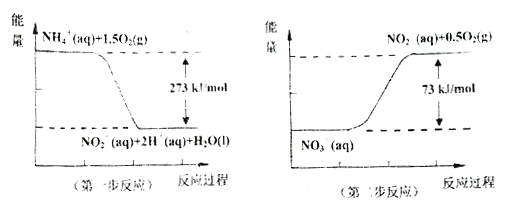
��д��1molNH4+(aq)ȫ��������NO3-(aq)���Ȼ�ѧ����ʽ��____________��
���𰸡� 2NH3-2e-+O2-=N2H4+H2O PbO2+2e-+4H+=Pb2++2H2O ���� 2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) ��H=-173.7kJ/mol NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ��H=-346 kJmol-1
����������1������ʧȥ���ӣ�����������Ӧ����õ����������ǰ���ʧȥ����ת��ΪN2H4�����������ڵĵ���ʣ����������缫��ӦʽΪ2NH3-2e-+O2-=N2H4+H2O����2���ŵ�ʱ������������Ǧ�õ����ӣ��缫��ӦʽΪPbO2+2e-+4H+=Pb2++2H2O���ŵ�ʱPb�Ǹ���������ʱ��Pb�缫Ӧ����������ӵ緹��_��������3����֪����2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ��H=-256.1kJ/mol����CO(g)+H2O(g)
CH3CH2OH(g)+H2O(g) ��H=-256.1kJ/mol����CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H=-41.2kJ/mol������ݸ�˹���ɿ�֪�٣��ڡ�2���õ�CO2(g)��H2(g)Ϊԭ�Ϻϳ��Ҵ����Ȼ�ѧ����ʽΪ2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) ��H=-173.7kJ/mol����4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2-��aq��+H2O��l����H=-273kJmol-1�٣��ڶ����Ȼ�ѧ��ӦΪNO2-��aq��+0.5O2��g��=NO3-��aq����H=-73kJmol-1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3-��aq�����Ȼ�ѧ����ʽΪNH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ��H=-346 kJmol-1��
CO2(g)+H2(g) ��H=-41.2kJ/mol������ݸ�˹���ɿ�֪�٣��ڡ�2���õ�CO2(g)��H2(g)Ϊԭ�Ϻϳ��Ҵ����Ȼ�ѧ����ʽΪ2CO2(g)+6H2(g)=C2H5OH(g)+3H2O(g) ��H=-173.7kJ/mol����4����ͼ��֪����һ���Ȼ�ѧ��ӦΪNH4+��aq��+1.5O2��g��=2H+��aq��+NO2-��aq��+H2O��l����H=-273kJmol-1�٣��ڶ����Ȼ�ѧ��ӦΪNO2-��aq��+0.5O2��g��=NO3-��aq����H=-73kJmol-1�ڣ��ɸ�˹���ɿ�֪��+�ڵ�1mol NH4+��aq��ȫ��������NO3-��aq�����Ȼ�ѧ����ʽΪNH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ��H=-346 kJmol-1��

 ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д� ���ɶ���ܲ��¿�ֱͨ��Уϵ�д�
���ɶ���ܲ��¿�ֱͨ��Уϵ�д�