题目内容
【题目】常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是( )
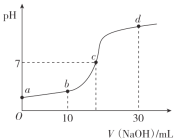
A.a点:pH=1
B.c点:V(NaOH)=20mL
C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.a→d过程中,水电离出c(H+)不断增大
【答案】C
【解析】
a点为0.1mol/L的CH3COOH溶液,b点是醋酸消耗一半,溶质为等量的醋酸和醋酸钠;c溶液呈中性,c(H+)=c(OH-);d点为醋酸钠和氢氧化钠的混合溶液,且醋酸钠是氢氧化钠的2倍,据此分析。
A.a点为0.1mol/L的CH3COOH溶液,醋酸为弱酸不完全电离,c(H+)<0.1mol/L,pH>1,故A错误;
B.若c点V=20mL,则醋酸和氢氧化钠恰好完全反应,溶质为醋酸钠,醋酸钠水解使溶液显碱性,pH不为7,由此可知c点:V(NaOH)<20mL,故B错误;
C.b点溶质为等量的醋酸和醋酸钠,且溶液呈酸性,由电荷守恒可得:c(Na+)+c(H+)= c(CH3COO-)+c(OH-),因c(H+)>c(OH-),则c(CH3COO-)>c(Na+),则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.随氢氧化钠体积的增加,醋酸逐渐转变成醋酸钠,当V=20mL时溶质完全是醋酸钠,因醋酸抑制水的电离,醋酸钠水解促进水的电离,此过程中水的电离程度逐渐增大;当V>20mL后,溶质为醋酸钠和氢氧化钠,氢氧化钠抑制水的电离,随氢氧化钠的增加水的电离程度逐渐减小,故D错误;
故选:C。

【题目】某同学研究金属锌与氯化铜溶液之间反应,在实验中该同学观察到的现象有:
i.产生少量气泡;ii.有红色固体生成;iii.溶液中产生白色沉淀。
为了解释上述现象,某同学查阅资料,获得如下信息:
编号 | 化学反应离子方程式 |
1 | Zn+Cu2+ |
2 | Zn+2Cu2+ |
3 | Cu++2Cl- |
4 | Cu++Cl- |
(1)请结合离子方程式解释产生少量气泡的原因:___。
(2)Zn与CuCl2反应生成白色沉淀的离子方程式是___。
(3)为了探究影响生成白色沉淀的因素,该同学进一步实验。取不同浓度CuCl2溶液,加入锌并振荡,均立刻产生少量气泡和红色固体,其他实验现象如下。
| 编号 | 浓度(rnol/L) | 试剂(锌均过量) | 实验现象 |
a | 0.5 | 锌片 | 立刻出现少量白色沉淀 | |
b | 1 | 锌片 | 立刻出现白色沉淀 | |
1 | 锌粉 | 立刻出现大量白色沉淀 | ||
d | 1 | 锌片、适量NaCl固体 | 少量白色沉淀,振荡迅速溶解 |
①对比实验a、b,实验结论是___。
②某同学从化学平衡的角度分析,d中白色沉淀溶解可能的原因是___(用离子方程式表示)。为证明该同学分析的原因正确,向b试管中加入适量___,振荡,观察到___,证明该同学分析的原因正确。
(4)利用沉淀法除去杂质在实际生产中应用广泛。
①在工业中冶炼锌,为了除去ZnSO4电解液溶液中的C1-,可加入___和___,生成沉淀而除去。
②通过进一步查阅资料得知:CuCl的形成与溶液的pH及Cu2+等离子浓度有关,一定条件下,通过实验得出pH、Cu2+浓度对Cl-沉淀的影响如图所示:
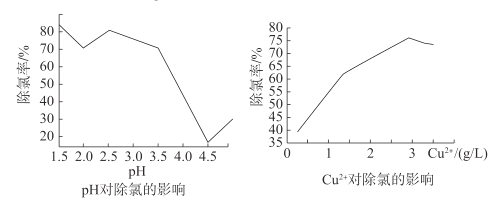
根据图,除去该电解液中Cl-的最佳条件是___。
【题目】钴酸锂(LiCoO2)可用作锂离子电池的电极材料。以红土镍矿为原料制备LiCoO2的工艺流程如图:
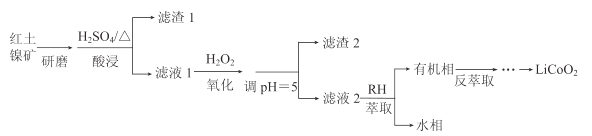
已知:①红土镍矿的主要成分有Fe2O3、FeO、SiO2、Al2O3、CoO、NiO等。
②20℃时,生成氢氧化物沉淀的pH
离子 | Fe2+ | Fe3+ | Al3+ | Ni2+ | Co2+ |
开始沉淀 | 7.0 | 1.9 | 3.4 | 7.2 | 7.1 |
沉淀完全 | 9.0 | 3.2 | 4.7 | 9.2 | 9.1 |
注:金属离子起始浓度为0.1mol/L
(1)上述流程中能加快反应速率的措施有__。
(2)H2O2的作用是将Fe2+氧化为Fe3+。
①加入H2O2发生反应的离子方程式是__。
②滤渣2的主要成分是__(写化学式)。
(3)萃取剂RH可用于对溶液中的Ni2+、Co2+进行分离与富集:Co2+(水相)+2RH(有机相)![]() CoR2(有机相)+2H+(水相)
CoR2(有机相)+2H+(水相)
①萃取剂浓度对溶液中Ni2+、Co2+的萃取率影响如图所示,萃取剂浓度的最佳取值为__mol/L。
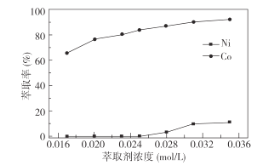
②在__(填“强碱性”或“强酸性”)介质中反萃取,使萃取剂再生而循环利用。
(4)向反萃取后的水溶液中加入稍过量NH4HCO3,得到CoCO3沉淀。将CoCO3与Li2CO3按n(Li):n(Co)=1的比例混合,鼓入空气,高温烧结,得到Li2CoO2。
①得到CoCO3沉淀的离子方程式是__。
②若使用(NH4)2CO3做沉淀剂,产物中会混有Co2(OH)2CO3,这是因为__。
③在空气中烧结反应的化学方程式是__。
【题目】下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是
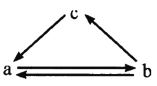
选项物质 | a | b | c |
A | Na2 CO3 | NaHCO3 | CO2 |
B | NO | NO2 | HNO3 |
C | FeCl3 | FeCl2 | Fe |
D | Al2O3 | Al(OH)3 | AlCl3 |
A.AB.BC.CD.D
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%