题目内容
【题目】从某废旧锂离子电池的正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,其流程如图所示:下列叙述错误的是

A. 在空气中灼烧可除去MnO2中的碳粉
B. 反应②中LiMn2O4是还原剂
C. 反应①可用氨水代替NaOH溶液
D. 从正极材料中可回收的金属元素有Mn、Li、Al
【答案】C
【解析】
A. C可与氧气反应生成气体,在空气中灼烧可除去MnO2中的碳粉,故A正确;
B. 4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O中Li元素的化合价升高,则LiMn2O4是还原剂,故B正确;
C. 氨水是弱碱,不与Al反应,不能代替NaOH,故C错误;
D. 正极材料(LiMn2O4、碳粉等涂覆在铝箔上)中回收金属资源,则可回收的金属元素有Mn、Li、Al,故D正确;
答案选C。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
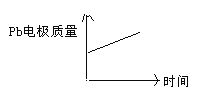
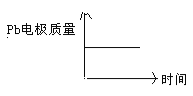
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
【题目】二氯化二硫(S2C12)用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体。S2Cl2是一种有毒并有恶臭气味的浅黄色液体,在300℃以上完全分解,其蒸汽遇水分解,易溶解硫磺;将适量氯气通入熔融的硫磺而得,过量的Cl2会将S2Cl2进一步氧化得到SCl2。以下是对S2Cl2的制备及研究,请回答下列问题:
Ⅰ.S2Cl2的制备
已知,各物质的熔沸点如下:
物质 | S | S2Cl2 | SCl2 |
沸点/℃ | 445 | 138 | 59 |
熔点/℃ | 113 | -76 | -122 |
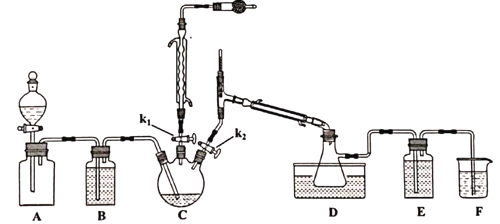
制备的流程为:
①A装置集气瓶中充满Cl2,打开A装置中的分液漏斗,打开k1、k2,一段时间后关闭k2。
②接通冷凝水,将C加热至135~140℃。
③一段时间后关闭k1,同时打开k2,最后在D中收集到浅黄色液体。
(1)实验室制取氯气的反应方程式_________________________________。
(2)A装置分液漏斗中盛装的液体是___________。
A.CCl4 B.饱和NaHCO3溶液 C饱和NaCl溶液
(3)滴加过程要缓慢,原因是____________________________________________。
(4)D装置中水浴温度应控制为___________,原因是_______________________________。
Ⅱ.S2Cl2纯度的测定
已知:S2Cl2遇水分解的化学方程式:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,取agⅡ中黄色液体于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的C0 mol/L的AgNO3溶液V0mL。再向锥形瓶中加入硝基苯,将生成的沉淀覆盖。加入适量Fe(NO3)3作指示剂,用C1 mol/L NaSCN溶液滴定至终点,消耗 NaSCN溶液V1mL(滴定过程发生反应:Ag++SCN-= AgSCN↓)
(5)滴定终点的现象为_________________________________。
(6)S2Cl2的纯度为___________(写出表达式);若滴定过程中未加硝基苯,则所得纯度___________。(填“偏大”、“偏小”、“无影响”)