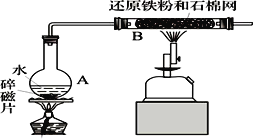
题目内容
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
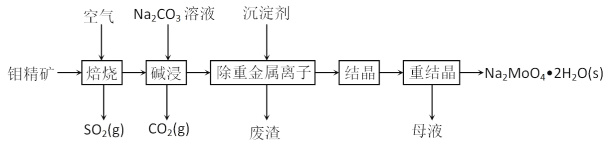
回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为____________________,氧化产物是__________________
(3)“碱浸”时生成CO2的电子式为______________,碱浸”时含钼化合物发生的主要反应的离子方程式为____________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________________。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为____________________________________________________________。
【答案】粉碎固体 2MoS2+7O2![]() 2MoO3+4SO2 MoO3、SO2
2MoO3+4SO2 MoO3、SO2 ![]() MoO3+CO32-=MoO42-+CO2
MoO3+CO32-=MoO42-+CO2![]() PbS MoS2+6NO3-=MoO42+2SO42+6NO
PbS MoS2+6NO3-=MoO42+2SO42+6NO![]()
【解析】
(1)提高焙烧效率的方法有:将钼精矿粉碎、可增加反应接触面积、提高焙烧效率,
故答案为:粉碎固体;
(2)“焙烧”时MoS2转化为MoO3,同时生成SO2,结合电子守恒和原子守恒可得发生反应的化学方程式2MoS2+7O2![]() 2MoO3+4SO2;该反应中Mo和S元素化合价都升高,氧化产物是MoO3和SO2;
2MoO3+4SO2;该反应中Mo和S元素化合价都升高,氧化产物是MoO3和SO2;
答案为:2MoS2+7O2![]() 2MoO3+4SO2;MoO3、SO2;
2MoO3+4SO2;MoO3、SO2;
(3)CO2的电子式为![]() ;“碱浸”时MoO3和Na2CO3反应生成CO2和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,离子反应方程式:MoO3+CO32-=MoO42-+CO2
;“碱浸”时MoO3和Na2CO3反应生成CO2和Na2MoO4,发生反应的化学方程式为:MoO3+Na2CO3=Na2MoO4+CO2↑,离子反应方程式:MoO3+CO32-=MoO42-+CO2![]() ;
;
答案为:MoO3+CO32-=MoO42-+CO2![]()
(4)由钼精矿含有少量的杂质为PbS可知,除重金属离子就是出去溶液中的Pb2+,因此废渣为PbS;
故答案为:PbS;
(5)硝酸作氧化剂,将MoS2氧化成MoO42和SO42,用NaNO3在酸性条件下氧化MoS2,发生反应的离子方程式为:MoS2+6NO3-=MoO42+2SO42+6NO![]() ;
;
答案为:MoS2+6NO3-=MoO42+2SO42+6NO![]() ;
;

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为_____.
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL 蒸馏水,振荡,恢复至室温,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论_____.
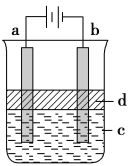
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中.
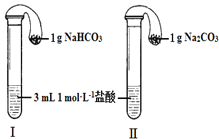
①两试管中均产生气体,_____(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是_____.
a 装置 I的气球体积较大 b 装置Ⅱ的气球体积较大
c 装置 I的气球体积等于装置Ⅱ的气球体积 d 无法判断
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应__________(写离子方程式). |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1CaCl2溶液 | 无白色沉淀 | Na2CO3溶液中的CO32﹣浓度很小,不能与CaCl2发生反应。 |
操作1反应的离子方程式为________________,实施试验后,发现操作2的现象与预测有差异,产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为____________.
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D