题目内容
【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:

已知:①Cr(OH)3 + OH- = CrO2- + 2H2O;
②2CrO2- + 3H2O2 + 2OH- = 2CrO42- + 4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)如图是用KOH固体配制250mL 6 mol·L-1 KOH溶液的过程示意图。

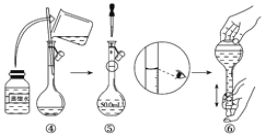
①请你观察图示判断,其中不正确的操作有(填序号)_____________________;
②其中配制250 mL溶液体积的容器是(填名称)_________________;
③如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(2)滤液Ⅰ酸化前,进行加热的目的是____________________________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是_______。
(3)下表是相关物质的溶解度数据:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 | K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①________________②________________。
称取产品重铬酸钾试样2.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水, 加入3mL淀粉指示剂,用0.1200 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
①写出重铬酸钾氧化碘化钠的离子方程式_______________________。
②滴定终点的现象为_________________________。
③若实验中共用去Na2S2O3标准溶液30.00mL,所得产品中的重铬酸钾的纯度 为_________(设整个过程中其它杂质不参与反应)。
④若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将_____________(填“偏高”、“偏低”或“不变”)。
【答案】 ⑴ ① ②⑤ ② 250 mL容量瓶 ③ 偏小
⑵除去H2O2 除去晶体表面残留的杂质,减小K2Cr2O7的损耗
⑶ 蒸发浓缩 趁热过滤 ①Cr2O72- + 6I-+ 6H+= 2 Cr3++3I2 + 7H2O ②加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色 ③88.2% ④偏高
【解析】实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收,先加KOH把Cr3+、Fe3+转化沉淀分离出来,再向沉淀中加双氧水和KOH,把Cr(OH)3转化为CrO42-,酸性条件下CrO42-转化为Cr2O72-,通过蒸发浓缩,过滤得到K2Cr2O7;
(1)①量筒不能用来溶解固体物质,故②错误;当容量瓶中液面距离刻度线1-2cm时改用胶头滴管滴加,故⑤错误,故答案为②⑤;
②配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管,其中配制250 mL溶液体积的容器是250mL容量瓶,故答案为:250mL容量瓶;
③配制溶液时,仰视刻度线,导致溶液体积偏大,浓度偏小,故答案为:偏小;
(2)H2O2不稳定,受热易分解,所以通过加热来除去H2O2;K2Cr2O7在冷水中的溶解度较小,用少量冷水洗涤K2Cr2O7,能除去晶体表面残留的杂质,还能减小K2Cr2O7的损耗;故答案为:除去H2O2;除去晶体表面残留的杂质,减小K2Cr2O7的损耗;
(3)根据表中数据可知温度较高时K2Cr2O7的溶解度较大,其它物质的溶解度较小,蒸发浓缩使杂质转化为固体析,温度较高时K2Cr2O7不析出固体,所以要趁热过滤;故答案为:①蒸发浓缩; ②趁热过滤;
①重铬酸钾氧化碘化钠的离子方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,故答案为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②根据反应原理,滴定终点的现象为加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色,故答案为:加入最后一滴溶液,溶液由蓝色变成无色,且30s内不再变成蓝色;
③由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算,
Cr2O72-~~~3I2~~~6S2O32-
1mol 3mol 6mol
n 0.2400×30×10-3mol
则250ml含重铬酸钾的物质的量为n=![]() ×10,则所得产品中重铬酸钾纯度为
×10,则所得产品中重铬酸钾纯度为![]() ×100%=88.2%,故答案为:88.2%;
×100%=88.2%,故答案为:88.2%;
④若滴定管在使用前未用Na2S2O3标准溶液润洗,导致滴定过程中消耗的Na2S2O3标准溶液体积偏大,测得的重铬酸钾的纯度将偏高,故答案为:偏高。