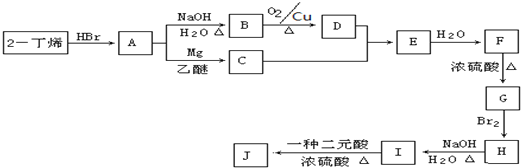
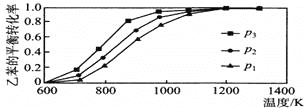
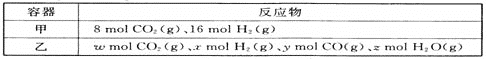题目内容
【题目】一定条件下,aL密闭容器中加入1molN2和3molH2发生N2+3H2![]() 2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是( )
2NH3的反应,下列叙述中能说明该反应已达到化学平衡状态的是( )
A.v(N2正)=2v(NH3正)
B.3v(H2正)=v(N2逆)
C.单位时间内有0.3molH2消耗的同时,生成0.2molNH3
D.单位时间内有1个N≡N键断裂的同时,有6个N—H键断裂
【答案】D
【解析】
当正反应速率等于逆反应速率时反应达到平衡状态,根据此分析进行解答。
A. v(N2正)=2v(NH3正)只能说明正反应在进行,不能说明反应达到平衡状态,故A选项错误。
B.化学反应速率之比等于化学计量数之比,故应为v(H2正)=3v(N2逆),故B选项错误。
C.只能说明反应在向正向进行,故C选项错误。
D.正反应发生,反应物中有1个N≡N键断裂的同时,逆反应也发生,反应物中有6个N—H键断裂,故正逆反应速率相等,化学反应达到平衡。
故答案选D。

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目